您當前的位置:檢測資訊 > 法規標準
嘉峪檢測網 2025-07-03 09:44
作為保障醫療器械安全性和有效性的關鍵環節,注冊質量管理體系核查尤為重要。然而,在實際核查過程中,由于法規要求、技術復雜性和企業管理水平等因素的影響,常常出現各種不同程度的問題。因此,系統性地分析和解決這些常見問題已成為提高注冊質量管理體系核查效果的必要措施[1]。本文旨在通過系統性分析醫療器械注冊質量管理核查的關鍵點,構建一套科學、有效的核查方法。
1、質量管理體系和注冊質量管理核查
1.1 質量管理體系缺陷及其影響
醫療器械注冊質量管理體系在保證產品安全性和有效性方面發揮著關鍵作用,不僅確保產品設計和生產過程的可控性,而且提供全面的質量保證和持續改進機制。然而,在實際實施過程中,質量管理體系可能因各種因素存在缺陷,常見的問題包括文件控制不力、設計開發過程不完善、生產過程控制不足等,這些問題可能導致產品質量不穩定、功能不符合預期或安全性風險增加,進而對患者安全構成潛在威脅[2]。因此,深入分析質量管理體系缺陷及其潛在影響對于制定有效的核查策略和優化質量管理體系至關重要。
1.2 注冊質量管理體系核查在醫療器械監管中的作用
注冊質量管理體系核查作為醫療器械監管體系中的重要環節,在確保醫療器械安全有效方面具有不可替代的作用[3],國內外相關法規和標準包括《醫療器械監督管理條例》《醫療器械生產質量管理規范》及相關附錄等,這些標準為核查提供了法律依據和操作指南,有助于規范核查行為,提高核查質量[4]。在整個監管體系中,注冊質量管理核查可以及時發現并糾正質量管理體系中的缺陷,不僅能直接預防由質量管理缺陷引起的潛在風險,而且能通過反饋促進企業質量管理體系的持續改進[5]。此外,核查還有助于增強企業的質量意識,提高整體醫療器械產業的質量管理水平。因此,將注冊質量管理核查有機融入監管體系,對于構建全方位、多層次的醫療器械安全保障機制具有重要意義。
2、注冊質量管理核查關注點的識別與分析
2.1 注冊質量管理核查關注點類別
本文采用系統文獻綜述和內容分析法,對國內外相關標準、指南和文獻進行了深入分析。通過對收集的資料進行歸納,最終確定了5大類關鍵關注點,包括質量管理體系文件、設計開發控制、生產過程控制、采購控制及不合格品控制。
2.2 關注點的重要性評估
本文采用層次分析法對注冊質量管理核查的關注點進行重要性評估,為制定科學合理的核查策略提供依據,有助于優化資源分配和提高核查效率[6],①構建層次結構模型,將注冊質量管理核查的總目標分解為5個關注點元素;②設計判斷矩陣A=(aij)n× n,基于9點量表法進行兩兩比較,其中,aij表示第i個元素相對于第j個元素的重要性比值。通過求解特征方程(A-λI)W=0計算最大特征值λmax及其對應的特征向量W=(w1 ,w2 ,…,wn)T,得出關注點的相對權重,權重向量W通過歸一化處理而得。

其中,CR表示一致性比率,CI表示一致性指標,RI表示隨機一致性指標,λmax表示最大特征值,n表示判斷矩陣的階數。計算得CR=0.03,小于0.1,表明判斷具有可接受的一致性。這一評估結果為核查人員合理分配注意力和資源提供了科學依據。
2.3 關注點的關聯性分析
本文采用結構方程模型分析各關注點之間的關聯性,基于理論假設構建了初始模型,使用最大似然法進行參數估計,模型可表示為:
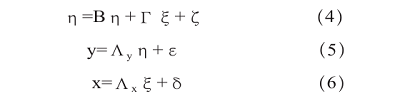
其中,η為內生潛變量向量,ξ為外生潛變量向量,B為內生潛變量之間的關系矩陣,Γ為外生潛變量對內生潛變量的影響矩陣,ζ為內生潛變量的殘差向量,y和x分別為內生和外生觀測變量向量,Λy和Λx為因子載荷矩陣,ε和δ為測量誤差向量。通過卡方檢驗等指標評估模型擬合度。結果顯示,質量管理體系文件對其他所有關注點都有顯著的直接影響;設計開發控制過程中,通過影響生產過程控制可間接影響產品質量。這些結果為質量管理體系的優化和改進提供了新的思路。
3、系統化注冊質量管理核查流程的構建
3.1 核查流程設計
本文基于關注點及其重要性和關聯性評估結果,設計了一套系統化的醫療器械注冊質量管理核查流程,該流程遵循風險導向原則,優先考慮對產品安全性和有效性影響較大的因素,同時兼顧邏輯順序和操作可行性(如附圖所示)。

附圖 核查流程示意圖
3.2 建立核查人員培訓體系
為確保系統化注冊質量管理核查方法的有效實施,本文構建了一套全面的核查人員培訓體系,該體系包括理論知識培訓、實踐技能訓練和能力評估3個主要模塊。理論培訓涵蓋醫療器械法規、質量管理體系標準、風險管理、核查技巧等內容,采用集中授課、在線學習和案例討論等多種形式。
3.3 制定質量控制措施
為保證核查結果的可靠性和一致性,本文制定了一系列質量控制措施,一是建立了標準化的核查操作規程,詳細規定了每個核查步驟的具體方法、判斷標準和注意事項;二是引入核查組內部復核機制,特別是對于高風險或判斷難度大的項目要進行內部復核;三是開發了核查質量監控指標體系,包括核查準確率、問題識別率、核查時效等,定期進行統計分析和趨勢監測。
3.4 方法實施與效果評估
本文構建了醫療器械注冊質量管理核查數據模型,采用計算機模擬方法評估系統化核查方法的實施效果,并基于本研究組前期建立的醫療器械企業質量管理評估數據庫(包含2020~2023年間40家企業的1500余次核查記錄),采用分層抽樣方法構建模擬數據集。模擬過程考慮企業規模、產品風險等級和質量管理成熟度等關鍵變量,使用蒙特卡洛法進行參數估計,模擬時間跨度設定為12個月。模擬結果顯示,采用新方法后,核查效率顯著提升,平均核查時間從5.2個工作日(95%置信區間:4.8~5.6天)降低到3.8個工作日(95%置信區間:3.5~4.1天);關鍵質量問題的識別率提升了23.5%(p<0.01),特別是在設計開發控制和生產過程控制領域的問題識別更為準確。
對結果進行分析可知,該方法的實施將對醫療器械行業質量管理體系的改進產生積極影響,在保持現有監管政策和市場環境穩定的前提下,醫療器械注冊過程中的重大質量問題發生率有望降低,企業質量管理體系的整體水平將得到提升。另外,通過敏感性分析可知,即使在不同參數設置下,核查方法的改進效果仍能保持穩定性(變異系數<0.15),該方法具有良好的應用價值,建議在推廣過程中建立完善的數據收集和分析機制,為方法的持續優化提供支持。
4、結論
本文通過系統分析醫療器械注冊質量管理核查的常見問題和關鍵關注點,構建了一套科學、有效的核查方法,該方法包括優化核查流程、全面構建培訓體系、嚴格控制質量措施等,能有效識別和防范醫療器械注冊過程中的質量管理風險。
參考文獻
[1] 秦蕾,杜邦. 無菌醫療包裝是無菌醫療器械安全的基本保證[J]. 中國醫療器械信息,2015,21(4)∶13-16.
[2] 易良英,陳燕華,王瓊霞. 消毒供應中心無菌物品包裝進展[J]. 現代預防醫學,2013,40(024)∶4574-4575.
[3] 徐徠,林森勇,胡麗君,等. 借鑒與創新:醫療器械注冊人制度構建研究[J]. 中國醫療器械雜志,2019,43(3)∶192-196.
[4]肖桂金,于淼,張薇薇,等. 對無菌醫療器械生產質量管理缺陷的分析與對策研究——基于2018 年國家醫療器械飛行檢查結果[J]. 中國醫藥導刊,2020,22(6)∶416-421.
[5]劉鳳林,陳洪忠,柴謙,等. 醫療器械注冊質量管理體系核查中真實性核查方法的探討[J].中國醫療器械雜志,2023,47(3)∶309-311.
[6]李烜,劉炳銳. 醫療器械軟件產品現場檢查要點研究[J]. 中國醫療設備,2024,39(6)∶120-123.
[7]劉光富,陳曉莉. 基于德爾菲法與層次分析法的項目風險評估[J]. 項目管理技術,2008(1)∶23-26.

來源:Internet


