您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2025-01-13 08:43
溶出曲線即在藥物溶出實驗中,藥物溶出量與時間的關系曲線。溶出曲線的檢測是模擬藥品在人體胃腸道環境中的溶解吸收而設計,以此來替代繁瑣、難以隨時開展且價格昂貴的人體生物利用度或等效性實驗。有區分力的溶出曲線如同顯微鏡,能反映出宏觀相似的兩種制劑間的微觀不同,是制劑內在品質呈現于外在的一種映射和載體,為制劑處方篩選、預測BE等效、藥品一致性評價等提供了一種簡單易行、成本低廉且具有一定可靠性的途徑。因此,在大多數口服固體制劑產品的開發過程中,若能尋找出有區分力的溶出曲線將使研究事半功倍。
1.漏槽條件
漏槽條件是指在37℃條件下,藥物所處釋放介質的濃度遠小于其飽和濃度,一般釋放介質的體積須為藥物飽和溶液所需介質體積的3~5倍。該條件的設定,亦是為了模擬藥物在人體的吸收分布:藥物在人體吸收后會迅速分布到體液,血液中的藥物濃度相較于吸收部位濃度要低得多,因此血液相對于胃腸道就會形成漏槽效應。如圖1所示,藥物溶解后在杯內逐步擴散,若外圍濃度迅速達到飽和勢必會影響藥物的進一步釋放,也就無法模擬藥物在體內的吸收過程,此時漏槽條件就起到了體外溶出對體內吸收的修正作用。那么有區分力的溶出曲線是否都需要滿足漏槽條件呢?首先,漏槽條件指的是API溶解特性方面的參數,屬于方法學的范疇,而區分力則是指溶出方法的參數,是為處方工藝開發而建立的溶出曲線的一個特征。從制劑角度來看,溶出度和溶出本質上并沒有直接的線性關系。在用于質控的溶出實驗中,一般期望制劑中90%以上的藥物能夠被釋放出來,因此,溶出度檢測通常都會滿足漏槽條件,而溶出曲線的設置主要用于對比制劑之間的接近或偏離程度,和漏槽并沒有必然的聯系。
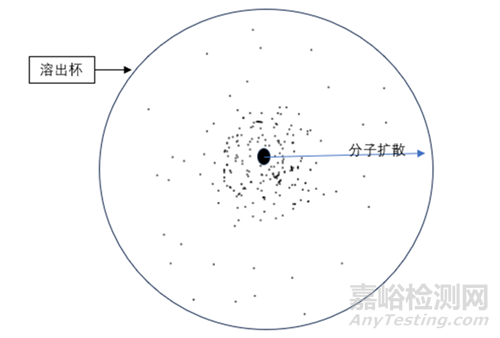
圖1
2.公開的溶出方法
誠如謝沐風老師所言,藥品行業是高科技、高利潤、高附加值的產業,原研廠家出于自身利益考慮,將最具區分力的內控方法秘而不宣、把較為寬松的質量標準公之于眾的做法是無可非議的,若是把這些標準奉為圭臬,不免會在仿制藥開發和品質評價中誤入歧途。那么是否USP/FDA所推薦的方法一定不能采用呢?也不盡然。對于某些品種,其公布的相關方法是極具區分力的,且亦有相關資料指出,USP/FDA推薦的溶出方法是經過臨床模擬和生物等效性建立了相關性的。因此作為仿制藥產品開發者,應客觀看待公開的溶出方法,并開展相關實驗驗證其對處方工藝篩選是否起到正向作用,而非一味的遵循或擯棄。更重要的是應從原研制劑入手來深度剖析解讀,獲取參比制劑的關鍵特性,再以此展開后續研究。
3.溶出方法的建立
3.1藥品的相關性質
在開發溶出方法之前,研究者須對藥品化合物的相關性質進行一定的了解。如其BCS分類、藥代動力學特性、API的Pka值、lgP值、API在不同pH條件下的溶出度差異及穩定性、API是否存在多晶型及不同晶型間的溶出度差異、溶出介質的離子強度對API溶解度是否有影響等等,這些信息對后續溶出介質的篩選具有指導性意義。
3.2溶出介質的選擇
如圖2所示,藥物在人體內的“旅行”會先后通過胃、十二指腸、空腸、回腸、結腸等器官,并在小腸(包括十二指腸、空腸、回腸)中停留時間最長。另外,小腸的比表面積最大、小腸膜也比胃中的膜更具滲透性,因此絕大多數藥品的吸收都在小腸,而非胃中。由于胃腸道環境過于復雜,常規的溶出試驗條件無需與胃腸環境完全一致,但溶出介質的選擇應考慮藥物的理化性質,并結合胃腸道環境的pH以及口服給藥后可能的暴露條件,如此才能最大程度上從藥品體內行為角度出發,更好地理解體外溶出數據。綜上,溶出介質一般采用pH值1.2~6.8(37±0.5℃)的水性介質,特殊情況下可采用更高pH介質,但一般不應超過8.0,且避免添加有機溶劑。對于硬膠囊、軟膠囊和明膠包衣片劑,可在溶出介質中加入一定量的酶,來抵消明膠交聯作用對藥物溶出的影響。對于不溶于水或難溶于水的藥物,可考慮在溶出介質中加入適當的表面活性劑,但需充分論證加入的必要性和加入量(推薦濃度0.01%-1.0%)的合理性。

圖2
3.3裝置與試驗條件
固體制劑常用的溶出裝置為籃法、槳法、往復桶法、流池法。其中籃法和槳法是普通制劑常用的試驗方法,其操作簡單,設備成本相對較低,耐用并能實現標準化,適用于口服藥物和外用藥物等領域,缺點是不能很好地模擬人體體內環境、精度較低。通常只有籃槳法的試驗結果不盡人意時才會考慮后兩種。往復桶法和流池法能更好地模擬人體體內環境,數據準確性更高、適用于更多類型的劑型,但設備成本相對較高。我們應當知曉,每種設備都有其自身局限性,不存在某種儀器設備能解決所有問題,需對不同情況進行合理選擇。
例如槳籃法,為了使溶出方法具有更高的區分力,應盡量保持溫和的攪拌條件。對于口服普通固體制劑來說,籃法和槳法設置的轉速范圍分別為50~100rpm和50~75rpm。BE試驗原則上選取的一般都是健康成年志愿者,因此設置更高或者更低的轉速均無法模擬藥物在成年人胃腸道中的狀態(主要用于老年人群的藥物除外)。同時,若轉速太慢會產生堆積現象造成虛假溶出,轉速太快又將不能區分制劑間的差異。常用轉速有50、75、或100rpm,但并非僅有這幾個數值可供選擇,研究者可根據具體品種及不同方法來設置范圍內的其他轉速。
4.過度區分
顧名思義,過度區分即溶出方法過于苛刻、區分力過高,將某些微小誤差、人為因素等極度放大,使數據所呈現出的變異性過高。其中一個比較典型的現象是,不同批次間的參比制劑在該檢測方法下亦顯示出不相似的結果(在固定處方工藝及相同設備下所生產出的參比制劑,其批次間的內在質量差距一般不會相差太大)。因此溶出方法的開發需要有一個度,既不能過度區分又不能無區分力。
5.示例
經查,某藥品相關信息如表1所示:
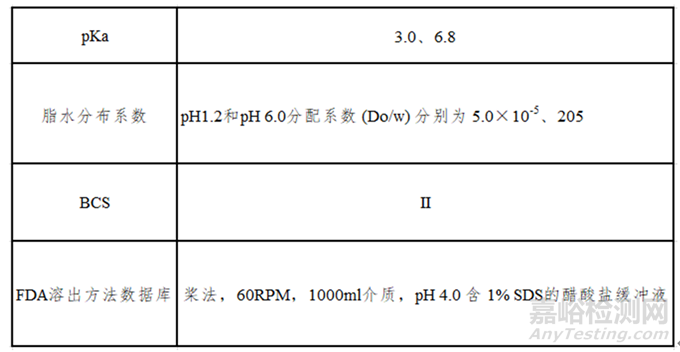
表1
經檢測,該API的溶解度隨著pH升高不斷增大(如圖2所示),為pH依賴性藥物。其在偏酸性介質中幾乎不溶解,當pH值大于5.0后,溶解度顯著增大。分別使用不同粒徑API及不同工藝參數所制樣品按照FDA溶出方法進行檢測,結果均顯示為快速溶出,因此該方法無法很好地指導后續處方工藝的篩選,需開發新的溶出方法。
該藥品屬BCSⅡ類,具有低溶高滲的性質,構建體內外相關性的可能性較高。考慮到藥物在pKa附近介質中溶解度差異較大,微小的pH改變就有可能加大溶出度的測定誤差,故需規避pKa點處的介質。結合其pH溶解度曲線數據,初步選擇pH6.0磷酸鹽介質開展研究并加以驗證。由圖3可知在槳法50及75rpm時,雖有一定的區分力,但90min溶出度均小于85%,故嘗試另外添加表面活性劑(如圖4所示),根據實驗數據最終選擇槳法50rpm,900ml,pH6.0磷酸鹽緩沖液+0.1%SDS的溶出方法來指導處方工藝的篩選。最終批樣品與參比制劑溶出數據對比如圖5所示。
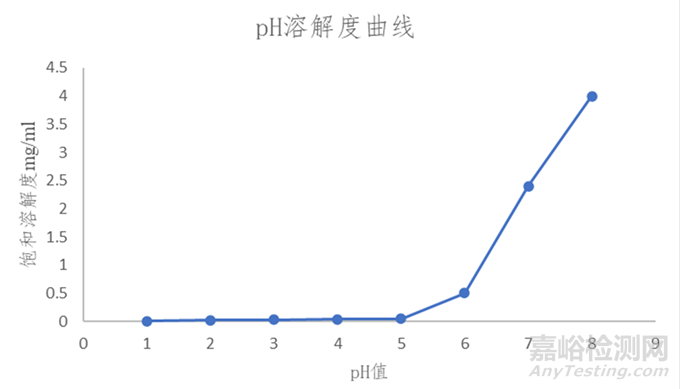
圖2
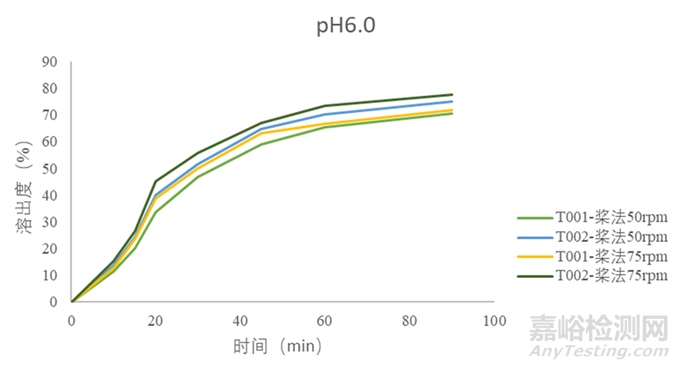
圖3

圖4

圖5
查詢參比制劑相關資料得知,其為低變異短半衰期產品。故預BE試驗采用兩制劑、單次給藥、兩序列、兩周期、餐后8例的設計方案。如圖6、圖7所示:
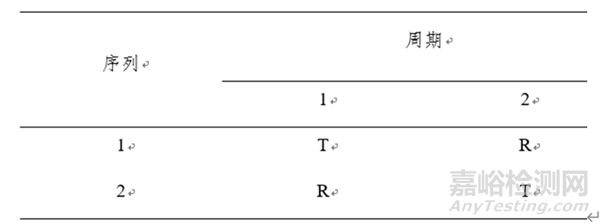
圖6
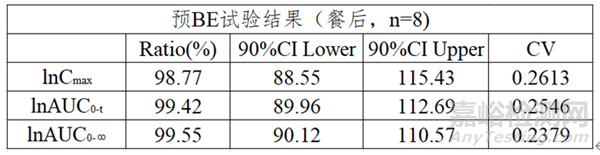
圖7
根據預BE結果推測自制品有較大概率能通過正式BE,進而設計正式BE方案為兩制劑、單次給藥、兩序列、兩周期、空腹及餐后各20例。數據結果(圖8)顯示自制品與參比制劑具有生物等效性。

圖8
6.總結
有人認為“有區分力的溶出曲線”本身就是個偽命題:首先,無論體外溶出數據做的多么完美, BE亦有不通過的可能,更有些品種即使體外溶出實驗相似因子小于50也能順利通過BE;再者,“區分力”到底區分的是什么?在人體實驗數據出來之前,那些被區分的特性參數是否真的有意義呢……不可否認,藥物的口服吸收是個復雜的過程,很難僅憑體外的一條或幾條曲線就能模擬出來,我們只有通過相關手段方法使仿制藥和原研藥做到最大程度的相似,才能更大概率地通過BE,而有區分力的溶出曲線正是一個可及性較高且相對有效的工具,能在一定程度上指導仿制藥的質量指標無限趨近于原研。它代表的不僅僅只是一條曲線,其背后包含更多的是研發者對品種各方面性質及信息的了解和全面考慮。或許目前沒有哪種方法能徹底終結“溶出”與“BE”之間的反復拉扯,但至少我們前進在正確的方向上。
參考文獻:
1. 普通口服固體制劑溶出度試驗技術指導原則
2. 普通口服固體制劑溶出曲線測定與比較指導原則
3.具有區分力的溶出曲線
4. 怎么提高BE通過率

來源:藥事縱橫


