解離常數(shù)(dissociation constant)是水溶液中具有一定解離度的溶質(zhì)的極性參數(shù)。絕大多數(shù)的藥物包含可電離的基團,多數(shù)為堿性的,也有部分為酸性。只有極少部分為中性,不能電離。pKa是電離常數(shù)Ka的負對數(shù)。對于酸和堿,通常均采用pKa表示。
對于酸:
HA = H+ + A-
pKa =-log([H+][ A-]/[HA])
對于堿:
HB+ = H+ + B
pKa =-log([H+][ B]/[HB+])
pKa表明了一種化合物的電離度,它是分子中基團與酸性、堿性的關(guān)系函數(shù)。藥物化學家可以改變分子中酸性或堿性的結(jié)構(gòu),以便得到期望的pKa,而pKa可以影響藥物的溶解性和滲透性。在之前的文章中也提到,pKa是影響化合物是否能夠和酸或者堿成鹽的關(guān)鍵。一般認為,當兩種組分的ΔpKa> 3時,形成鹽;而0 < ΔpKa <3是可能形成共晶,也可能形成鹽,沒有明確的界限。在進行臨床前制劑開發(fā)時,化合物的pKa也是是否可以使用調(diào)節(jié)pH方式增溶的依據(jù)。影響pKa大小的因素主要有以下幾個。
1. 電荷(charge)
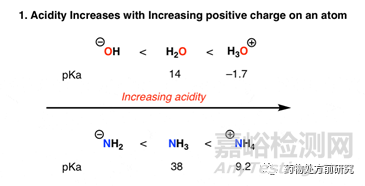
從pKa的定義可知,pKa反映的是分子脫去質(zhì)子(H+)的能力。分子越是容易脫去質(zhì)子,則其酸性就越強,pKa也就越小;相反,分子越是難脫去質(zhì)子,則其酸性越弱,pKa也就越大。因此,如果分子上離開一個質(zhì)子,則其形式電荷(formal charge)就降低一個單位。此時,再失去一個質(zhì)子就變得困難一些。如下圖所示,當水分子得到一個質(zhì)子變成H3O+,它的質(zhì)子容易脫去,所以pKa相比H2O變小。而如果脫去一個質(zhì)子,變?yōu)榱u基(OH-),則很難繼續(xù)脫去質(zhì)子。
2. 原子的作用
從元素周期表,橫向比較,電負性越大,則酸性越強。已知C、N、O、F中F的電負性是最大的,所以HF的pKa是最小的。而縱向比較,原子的半徑越大,則酸性越強。已知F、Cl、Br、I中I的原子半徑是最大的,所以HI的pKa是最小的。同樣,S的原子半徑大于O,所以H2S的pKa小于H2O。元素的電負性越大,表示其原子在化合物中吸引電子的能力越強。也就是說,電負性越大,越容易得到電子,形成負離子;電負性越小,越容易失去電子,形成正離子。形成負離子也就是和H+的作用變?nèi)酰匀菀酌撊ベ|(zhì)子。而隨著原子半徑的增大,負離子對H+的吸引力下降,所以容易脫去H+,酸性增強。

3. 共振(Resonance)
共振(共軛)對化合物的酸性有很大影響,一個典型的例子就是苯酚和水,苯酚的酸性是水的數(shù)百萬倍。如下圖所示,甲醇和苯酚雖然都有一個羥基,甲醇的羥基連著甲基,而苯酚的羥基連著苯基。甲醇的酸性是比較弱的,而因為苯環(huán)可以形成共軛結(jié)構(gòu),O上的電子可以跑到苯環(huán)上,所以酚羥基中的質(zhì)子更容易離去。因此,苯酚的酸性要強于甲醇。而甲醇和乙酸也是類似的情況,乙酸中的-OH的質(zhì)子可以更容易離去,所以酸性更強。誘導效應非常重要,在藥物分子堿性位點的判斷中常常起到關(guān)鍵作用。

4. 誘導效應(Inductive effects)
電負性的原子可以吸引負電荷,從而使得共軛堿更穩(wěn)定。已知電負性大小順序為F﹥Cl﹥Br﹥I,所以F吸電子作用最強,F(xiàn)取代的酸酸性最強。如下圖所示,乙酸的酸性是最弱的,而當甲基中的H被鹵原子取代后,F(xiàn)代乙酸酸性是最強的,而I代乙酸酸性是最弱的,但強于乙酸。很容易理解,如果電負性原子和H的距離越遠,則對其影響越小。
5. 軌道(Orbitals)
電子軌道對酸性也有影響。如下圖所示,如果s特性越高,則酸性越強。sp3雜化s特性的比例是25%,sp2雜化s特性的比例是33%,sp雜化s特性的比例是50%。也就是說sp雜化的分子酸性最強。
對于藥物分子而言,絕大多數(shù)化合物都是游離堿或者游離酸。游離酸的情況比較簡單,因為游離酸大多數(shù)都是羧酸,而羧酸的pKa基本在4左右。所以在對化合物pKa進行判斷時要注意上面的這些影響因素,特別是共軛效應。下圖所示的是甲氧芐啶的化學結(jié)構(gòu)式。從結(jié)構(gòu)式看有兩個氨基,氨基是很強的堿。但兩個氨基連在嘧啶環(huán)上,所以會形成共軛,所以此時堿性位點不是氨基,而是嘧啶環(huán)上的N。甲氧芐啶可以和很多酸形成鹽,通過鹽的單晶結(jié)果可以知道是哪個位點成鹽。通過檢索CCDC晶體結(jié)構(gòu)庫,發(fā)現(xiàn)成鹽位點確實是嘧啶環(huán)上的N。