您當前的位置:檢測資訊 > 行業研究
嘉峪檢測網 2022-01-10 21:02
剛剛過去的2021年,是國家正式啟動仿制藥一致性評價工作以來的第6個年頭。
CPM新藥研發監測數據庫數據顯示,在這一年里,共有573家企業1965個品規的仿制藥通過一致性評價或視同通過一致性評價,同比增長超過70%。截至2021年底,累計共652個品種(以通用名+劑型計,下同)通過一致性評價(含視同通過,下同),涉及780+家企業3700+個批文。下面我們一起來看看,這一年來一致性評價過評與申報有些怎樣的變化?又能帶給我們什么樣的啟示?
首次過評品種含量下降
2021年度,累計過評品種數從年初的426個增加至年末的652個,也即本年度獲批的近2000個過評仿制藥批文中,含首次過評品種226個。而在上一年度,獲批的過評仿制藥批文數不到2021年的6成,但其中首次過評品種數達到了215個,僅比2021年略低。
首次過評品種含量的下降,說明新獲批的過評仿制藥更多地集中到一些已經有企業過評的品種上,一些熱門品種扎堆過評,與此同時,大量仿制藥品種無企業開展一致性評價工作。長此以往,勢必造成大量仿制藥品種退出市場,由此可能帶來的臨床藥品短缺風險,值得關注。
圖1. 過評批文數年度變化趨勢

過評注射劑占比翻倍
2021年度獲批的過評仿制藥批文中,注射劑型批文數占比達到44%,正好是上一年度的一倍。2020年年中是國家正式啟動注射劑一致性評價工作的時間,因此,出現這一結果也是順理成章。
圖2. 過評仿制藥劑型分布

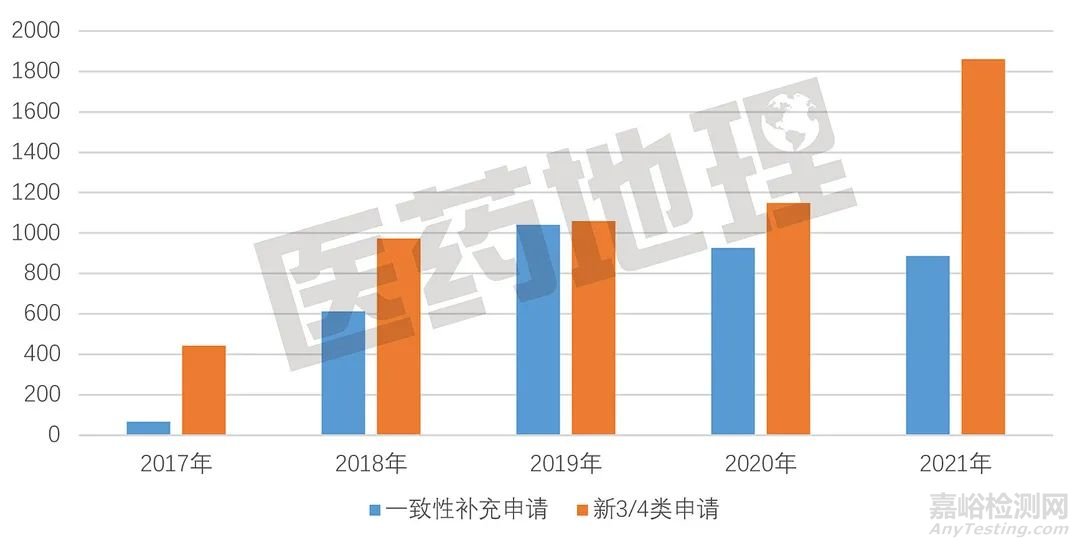
一致性補充申請和新3/4/5.2類申請數量
一降一升,走勢迥異
從仿制藥一致性評價申報情況來看,2021年度CDE承辦的受理號總量同比大幅增長,漲幅超過30%,同樣超過上一年度。不過,其中的一致性補充申請和新3/4/5.2類申請,呈現出截然相反的走勢。在仿制藥批文整體過評率不到5%且政策條件已經較為明朗的背景下,一致性補充申請量自2019年后逐年下降,而新3/4/5.2類申請逐年上升,反映出仿制藥企業更傾向選擇開展仿制藥新項目研發,而不是舊標準仿制藥的過評。
確實,在醫保控費和醫藥集采之下,仿制藥暴利時代一去不復返,有限的資源不宜浪費在過時老化品種上,只有積極拓展產品線,發展高仿、難仿和首仿藥,開展臨床急需、供應短缺、療效確切、新專利到期藥物的仿制開發,才能搶占新市場,獲得更多發展機會。
圖3. 仿制藥一致性評價申請受理量年度變化趨勢

來源:醫藥地理


