您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2019-08-29 11:00
本文旨在通過梳理已備案開展的生物等效性( BE)試驗,為科學、有序推進仿制藥一致性評價提供科學依據與參考。通過近3 年仿制藥一致性評價生物等效性試驗備案平臺數據,從品種、劑型、是否處方變更、適應證及市場規模等多個維度,詳細分析我國仿制藥一致性評價BE 試驗備案情況及特征。
仿制藥一致性評價BE 試驗備案品種自2017 年呈現逐月上升的態勢,備案主要集中在我國東南沿海省份所屬企業,適應證以高血壓、糖尿病及抗感染藥物為主; 289 基本藥物目錄品種BE 備案占比超過60%,處方變更的備案信息占80%以上。我國仿制藥一致性評價BE 備案具有明顯的地域特征,主要BE 試驗開展品種為原國家基本藥物目錄中的固體口服制劑,大多數已上市仿制藥的一致性評價需進行處方及生產工藝的變更。
正 文
為優化臨床試驗申請的審評審批,根據《國務院關于改革藥品醫療器械審評審批制度的意見( 國發[2015]44 號) 》要求,仿制藥生物等效性( BE)試驗由審批改為備案。2015-12-01,原國家食品藥品監督管理總局( CFDA)發布《關于化學藥生物等效性試驗實行備案管理的公告( 2015 年第257 號) 》,正式啟動新報仿制藥的BE 試驗備案制。仿制藥一致性評價工作中,包含BE 試驗和臨床有效性試驗。基于一致性評價工作當中開展再評價的仿制藥均是已獲批上市仿制藥的考慮,上述兩類試驗也均采用備案制。
根據原食藥監總局領導和仿制藥質量一致性評價辦公室的要求,國家藥品審評中心( CDE)設計了“仿制藥質量和療效一致性評價臨床試驗備案平臺”( 以下簡稱“一致性評價臨床試驗備案平臺”) 網站,嵌套在“藥物臨床試驗登記與信息公示平臺”網站( www. chinadrugtrials. org. cn) 中[1],于2016-10-26上線試運行。
本研究通過對化學仿制藥生物等效性與臨床試驗備案信息平臺近3 年來的備案信息進行分析,描述近3 年我國已上市仿制藥一致性評價BE 試驗備案的主要特征,為科學、有序推進仿制藥一致性評價提供科學依據與參考。
材料與方法
1 數據來源
本研究數據提取自國家食品藥品監督管理總局“化學藥BE 試驗備案信息平臺”數據庫,選取其中仿制藥一致性評價BE 試驗備案平臺( 面向已上市的化學藥) 2016 年至2018年度備案信息。選取備案信息中月份、藥品名稱、企業名稱、完成時間、備案類型等多個維度進行梳理、匯總。
2 研究方法
本研究采用描述性統計分析的方法,采用備案藥品名稱、備案時間、備案企業所在省份等指標,分析我國2016 年至2018 年度仿制藥一致性評價BE 備案情況。
結 果
1 BE 備案的總體情況
截至2018 年12 月31 日,備案平臺共收到已上市化學藥備案信息1241 條,其中狀態為“已備案”信息957 條,“備案中止”信息283 條,2 條測試信息。本文分析的主要信息來源為順利進行備案的957 條BE 備案信息。
2 年度、月度BE 備案情況
2. 1 2016 年至2018 年度分布情況
2016 年至2018 年備案平臺中,BE 試驗備案數量逐年增加。2016 年度備案數量9 件,總數占比0. 94%; 2017 年度備案數量244 件,總數占比25. 5%;2018 年度備案數量704 件,總數占比73. 6%。
2. 2 2017 年至2018 年月度分布情況
2017 年至2018 年BE 試驗備案平臺中,月度BE試驗備案數量保持穩定增長,見圖1。

3 具體品種BE 備案情況分析
3. 1 備案品種劑型分布及處方工藝變更情況
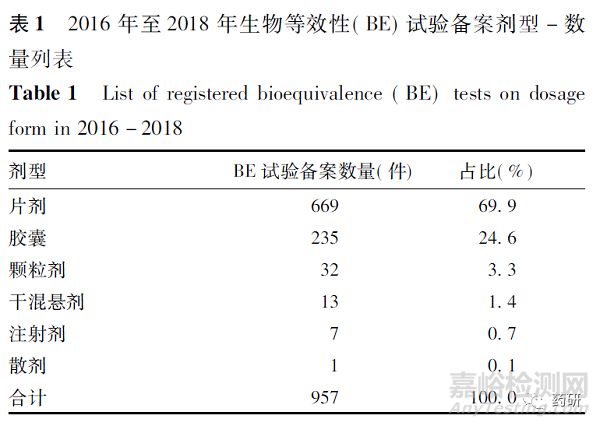
近3 年來完成BE 試驗備案信息,從劑型角度進行分析可見,主要備案的品種為片劑以及膠囊劑型,復雜注射劑共7 條BE 試驗備案信息,具體為丙泊酚中/長鏈脂肪乳注射液、丙泊酚乳狀注射液、注射用依諾肝素鈉等5 個品種。具體劑型分布情況,見表1。
根據申請人BE 試驗備案信息中的備案類型可知,957 件備案信息中,799 件BE 試驗用樣品進行了處方工藝的變更( 占比83. 5%) ,表明為達到與參比制劑具有相同的溶出曲線以及生物等效,大多數國產仿制藥需進行處方以及生產工藝的研究與再開發。3. 2 國家基本藥物目錄( 2012 版) 289 品種備案情況近3 年BE 試驗備案成功的957 條信息中,共涉及292 個品種,其中屬于國家基本藥物目錄( 2012版) 289 品種599 條信息( 62. 3%) 、126 個品種( 289基藥品種中占比43. 5%) 。
3. 3 主要備案品種分布、適應證及市場規模情況
根據備案統計表格可以看出,10條以上條備案信息的品種共計14 個( 累計占比4. 9%) ,共有涉及BE試驗備案296件( 占比30. 9%) ; 5 條以上條備案信息的品種共計53 個( 累計占比18. 2%) ,共有涉及BE試驗備案544 件( 占比56. 8%) ,BE 試驗開展品種具有較高的集中性,主要BE 試驗備案品種適應證為抗感染、高血壓、糖尿病等重大疾病,2016 年至2017 年度市場銷售總額均較高。具體品種及數量分布情況,見下表2 和表3。


4 各省份生產企業BE 備案分布情況
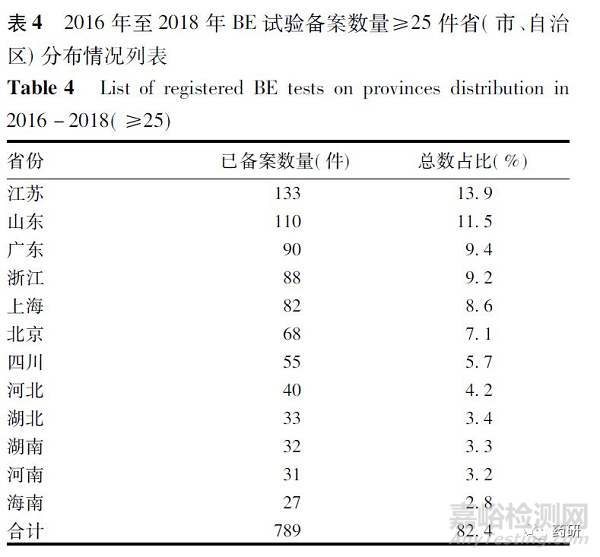
957 條BE 試驗備案信息共涉及411 家生產企業,按照企業所屬省、自治區、直轄市劃分,共有12 個省( 市、自治區) 所屬企業近3 年BE 備案數量超過25件,占全部備案件數的82. 4%,其中江蘇與山東兩省的BE 試驗備案數量均超過100 件; 內蒙古、廣西、青海等11 個省( 市、自治區) 所屬企業BE 備案數量不足10 件,BE 備案數量僅占全部備案件數的2. 7%。BE試驗備案數量≥25 件省( 市、自治區) 分布情況,見表4。
討 論
1 開展BE 備案的化學仿制藥主要特征
2017 年以來,仿制藥一致性評價BE 試驗備案的品種呈現逐月上升的趨勢,適應證以高血壓、糖尿病及抗感染等市場份額較大的藥物為主; 品種方面,原國家基本藥物目錄( 2012 版) 289 品種占備案信息總數的60% 以上,處方變更備案信息占全部信息的80%以上。
2 仿制藥一致性評價的開展存在較為明顯地區差異
近3 年來,仿制藥一致性評價BE 備案多集中在我國東南部沿海省份所屬企業。從監管角度,對于備案相對集中的省( 市、自治區) ,開展BE 試驗的機構相對較多,應加強日常監督檢查的力度; 對于備案開展較少的省( 市、自治區),則應加強機構建設,做好技術指導與資源共享,力爭做到各地區均衡發展。
3 仿制藥一致性評價后續工作的推進與思考
我國仿制藥質量參差不齊,重復品種過多,部分品種的生產企業間存在惡性競爭現象,通過仿制藥一致性評價,可有效的提高藥品質量,降低醫療總費用支出,減輕患者經濟負擔[2]。對于BE 試驗備案以及開展高度集中的品種( 如阿莫西林膠囊、苯磺酸氨氯地平片、鹽酸二甲雙胍片BE 備案數量均≥40 件) ,可能造成BE臨床資質機構資源的浪費,也可能因過評品種過多導致市場競爭加劇,并給獲批后監管帶來風險。
2016 年2 月《國務院辦公廳關于開展仿制藥質量和療效一致性評價的意見》( [國辦發]8 號) 公布,明確了“國家基本藥物目錄( 2012 版) 中2007 年10 月前批準上市的化學藥品仿制藥口服固體制劑應在2018 年底前完成一致性評價”,從近3 年BE 試驗備案情況看,基本藥物目錄(2012 版) 中289 品種備案條數占60%以上,為企業BE 試驗的開展主體。
仿制藥一致性評價是一項復雜的工作,國際上尚沒有完整成熟的經驗可借鑒,目前一致性評價工作在推進過程中,仍面臨著提升科學認知,參比制劑選擇、評價方法確定、臨床試驗資源不足等諸多挑戰。基本藥物是仿制藥一致性評價工作的重點,對于保障公眾用藥具有重要意義。隨著2018 年年底《國家基本藥物目錄( 2018 年版) 》和《國家藥品監督管理局關于仿制藥質量和療效一致性評價有關事項的公告》( 2018年第102 號) 的發布,對納入國家基本藥物目錄的品種,不再統一設置評價時限要求。預計未來BE 試驗備案及開展將進一步趨于品種的理性化與分散化,監管機構也將繼續發布相關藥學研究、BE研究等技術指南及參比制劑目錄,建立符合國際通行做法的現代化仿制藥審評體系,提升我國制藥行業整體水平,保障人民用藥安全、有效,促進企業國際競爭能力。

來源:Internet


