近年來,小核酸藥物成為生物制藥企業的研發熱點,小核酸藥物專指靶向作用于RNA或蛋白質的一類寡核苷酸分子,包括反義寡核苷酸(ASO)、siRNA、aptamer等。截至目前,我國已上市的小核酸藥物總共有兩款,一款為諾西那生鈉(spinraza)全球首個用于治療兒童和成人脊髓性肌萎縮癥(SMA,致命性遺傳病)的新藥,2019年spinraza在中國獲批;另外一款為樂可為(leqvio),是一款長效降脂藥,2023年08月在中國獲批;這兩款藥均是進口至中國。通過查詢CDE得知,諾西那生鈉和樂可為的注冊分類屬于化學藥5.1類。
雖然小核酸藥物是按照化學藥物申報,那么小核酸藥物的研究要點有哪些?下面從序列設計思路、單體合成、序列合成、質量控制、遞送系統等五個方面進行討論。
序列設計思路
小核酸藥物的序列是藥物的核心,序列的設計也是重中之重的任務,下面我們來粗略地探討下序列設計的思路。
首先需要確定ASO的基本需求,確定是屬于招募RNase-H還是不招募RNase-H;根據文獻得知,ASO的作用機制主要分為兩類,一類為招募RNase-H,另一類是不招募RNase-H;在ASO與目標RNA結合后,通過招募RNase-H的機制主要是利用RNase-H,切割ASO-mRNA,使mRNA被裂解;而另一類不招募RNase-H的作用機制,主要是通過ASO與mRNA緊密結合,使得mRNA抑制翻譯和轉錄,作用機制見下圖1;了解了我們的目標機制,我們還需要了解目標對象是什么?目標基因是什么-外顯子,間隔子還是其他?
第二步:設計8~10個ASO序列,在設計ASO序列時,需要考慮的因素:①確定某些序列是否會加強或減弱ASO的活性;②G/C的含量:大于55%的G/C的含量會增強ASO的結合力;③可以通過計算模型來設計ASO;④確保序列能夠識別的是唯一基因;理想的ASO是有大于3個堿基與其他基因無法匹配;
第三步:確保是否可以購買到合適的單體用于制備ASO;比如:對于需要招募RNase-H,可以采用PS修飾;對于不需要招募RNase-H,可以采用PS修飾或PMO修飾;對于招募RNase-H機制,可以對前5個和后5個堿基進行2'位置進行修飾,對于非招募RNase-H的藥物,可以對所有堿基進行2'位置進行修飾;
第四步:通過適當的體外細胞研究,篩選8~10個ASO;確保基因能夠在細胞中被表達;使用6~200nM濃度的ASO進行實驗,收集24h的mRNA并分析它的有效性,選擇4~5個有效的ASO進行體內實驗;
第五步:在體內模型篩選合適的ASO,確保目標ASO能夠在小鼠/小鼠細胞中表達;
第六步:選擇最佳的ASO進行藥效研究,確定ASO的有效劑量。
圖1 ASO的作用機制[1]
序列設計思路[1]
合成過程的研發要點
核苷單體合成的要點
小核酸藥物的關鍵原料為核苷單體,如圖2所示,DNA的亞磷酰胺單體主要是由堿基、脫氧核糖、5'-DMT和3'端的2-氰乙基以及二異丙胺基組成;而RNA的亞磷酰胺單體在DNA的亞磷酰胺單體的基礎上,需要對2'-OH進行保護,該保護基團一般為TBDMS(叔丁基二甲基硅基);此外,由于腺嘌呤,鳥嘌呤和胞嘧啶上存在伯胺基,因此也需要一定的基團保護,通常用作這些氨基保護基的是酰基如苯甲酰基(Bz),乙酰基(Ac),異丁酰基等;然而,對于該步驟中,最關鍵的
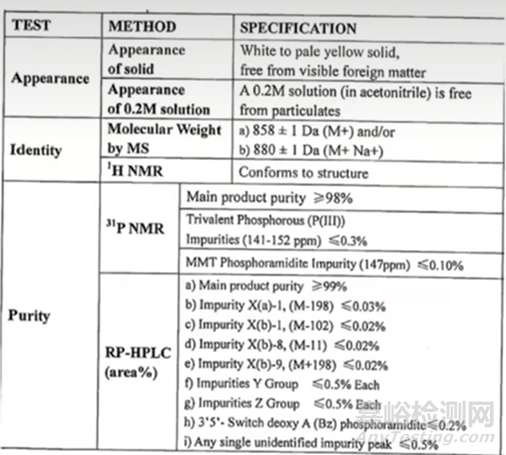
主要有三個,第一個是進行必要的化學修飾,采用何種化學修飾將會影響最終的核酸藥物的成藥性、以及藥物的酶抗性;目前常見的修飾方法主要有,磷酸骨架的修飾(比如PS)、2'位羥基核糖的修飾(比如:2’-O-甲基修飾,2’-O-甲氧乙基修飾(2’-MOE),氟(F)等取代),核糖五元環骨架修飾(比如:LNA,PMO等);第二個關鍵點:核苷單體的質量控制,由于核苷單體合成技術環節眾多,同時核苷單體經過各種修飾,結構也變得更加復雜多變,雜質團的種類也變得更加繁多,因此在質量控制上也是具有極大的挑戰;通常情況下,亞磷酰胺單體的純度要求一般≥99.0%,下圖3是某單體質量要求的質量標準要求;第三個關鍵點:由于市場目前處于早期,要使單體投入生產領域其成本較高,特別是要想獲得比較大的生產量,也是較大的挑戰之一。
圖2 亞磷酰胺單體結構式[2]
圖3 單體的檢測質量標準[3]
序列合成的挑戰
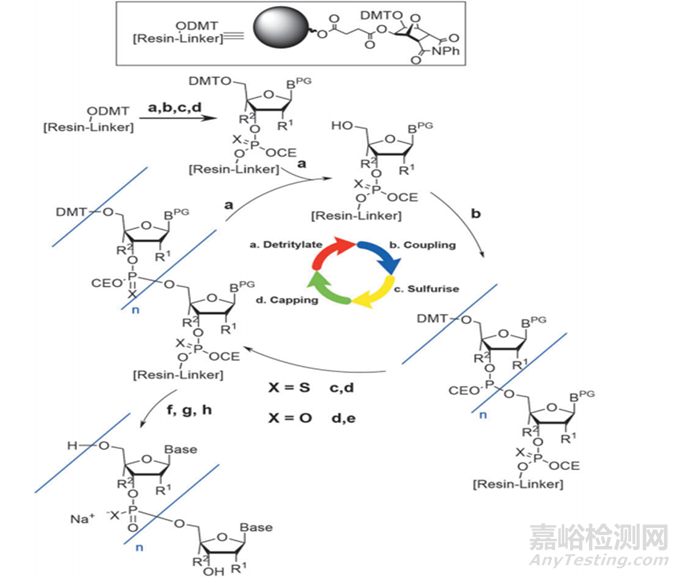
單體合成后,需要進行下一步,對其序列進行合成純化,工業上合成純化方法主要包括:化學合成法、RNA酶解法、微生物發酵法及生物催化法,其中化學合成主要方法又包括反相色譜法(固相合成—反相色譜純化—脫三苯甲基化—乙醇沉淀法等—凍干)、離子交換層析法(固相合成—離子交換層析—濃縮/深層過濾—凍干)、疏水層析結合離子交換層析(固相合成—疏水層析—脫三苯甲基化—離子交換—UF/DF—原料藥溶液);目前已上市的核酸藥物大多采用化學合成法中反向色譜法和離子交換層析法,該方法的具體步驟包括去DMT(脫三苯甲基)保護、偶聯、氧化、加帽,循環(見下圖4)達到所需要的序列長度后,再進行裂解和脫保護(Cleavage and Deprotection,C&D),最終得到我們所需要的序列;然而,在這一過程中,若工藝參數控制不好很有可能會產生一系列的雜質,包括產生N-X序列如N-1,N+X的序列(longmer sequences)如N+G,硫代磷酸酯鍵(PS)產生的非對映異構體和氧化產生PO雜質,胞嘧啶和5-甲基胞嘧啶脫氨基引起的雜質,其他雜質如堿基脫嘌呤雜質,2'-5'連接異構雜質,序列異構體等。
圖4 寡核苷酸合成路線圖[4]
N-X序列(shortmer sequences),如N-1的產生主要原因包括:①脫保護時間的長短,以及脫保護劑的酸堿性,脫保護反應時間不夠/脫保護劑酸性太弱會產生N-1雜質;而脫保護時間又取決于流速和柱子的尺寸;②空間位阻導致脫保護劑脫離效率低產生N-1的雜質;
N+X的序列(longmer sequences),如N+G,N+A的產生主要原因包括:①脫保護試劑沖洗不干凈導致N+1雜質的產生;②亞磷酰胺單體自身形成二聚體,然后與5'-OH反應;③新加入的亞磷酰胺單體被偶聯兩次;
硫代磷酸酯鍵(PS)產生的非對映異構體和氧化產生PO雜質主要原因:在氧化過程中,使用的氧化試劑可以將已形成的PS鍵氧化為PO鍵;
胞嘧啶和5-甲基胞嘧啶脫氨基引起的雜質:在斷裂和脫保護過程中,甲胺與胞苷殘基(被苯甲酰基保護)反應形成N-4-甲基胞苷雜質。
由此可見,序列合成過程中主要有以下幾個關鍵要點,第一:合成工藝,工藝參數以及試劑的質量將會影響藥物的質量,比如:柱子使用尺寸、流速、脫保劑的酸堿度等等。第二:核酸原料藥生產使用固相合成技術,其在工藝放大和質量控制上存在較高壁壘;第三:核酸原料藥固相合成配套設備、潔凈環境等前期投入非常大;
質量控制的挑戰
由于小核酸藥物處于早期,目前無明確的法規對其進行指導,2021年FDA[5]發布關于反義寡核苷酸藥物的化學、生產控制指南中提出;對于原料藥,FDA推薦采用兩種方法進行鑒別,鑒別包括:分子量及序列,其他方法包括熔點(Tm)、液相保留時間;原料質量研究內容包括:序列(質譜分析)、熔點(Tm)、成鹽形式、殘留溶劑、水分、微生物檢測、細菌內毒素、雜質個數、特定雜質含量、總雜、元素雜質、重金屬等等;
關于雜質限度的制定,暫無明確的法規進行參考,根據OSWG白皮書[6]第10章關于寡核苷酸藥物中雜質中指出,建議鑒定限為1.0%,界定限為1.5%;文章給出制定該標準的理由有三點:第一:寡核苷酸藥物的新雜質或未知雜質的大部分來源于合成,而這些雜質的化學結構很可能與目標化合物相似,它們的化學性質也有可能與目標化合物相似,比如水溶性、與蛋白結合力、分子量等;第二:由于寡核苷酸藥物的分子量與小分子的分子量差異很大,比如,小分子的分子量大概為500Da,而寡核苷酸藥物的分子量可能要達到5000Da,它們的分子量相差10倍,因此,在相同的臨床劑量下,由于分子量的差異,寡核苷酸的雜質水平為1.0%與小分子藥物0.1%的數量相當;第三:根據現有的毒理學數據,無法證明寡核苷酸藥物的毒性是來源于雜質。同時文章中,還給出了關于寡核苷酸藥物雜質鑒定決策樹(詳見下圖5);具體報告限或鑒定限(小分子化藥與OSWG白皮書)對比表。
圖5寡核苷酸藥物雜質鑒定決策樹[6]
對于小核酸藥物藥物分析中還存在一個很重要的要點,那就是雜質分析方法的開發,由于在化學合成過程中,很容易產生n-1的雜質,該雜質通常比母體少一個堿基,因此它的的化學性質與目標化合物也是非常相似的,這就容易造成分離的困難,特別是對于較長序列的藥物,據文獻報道,序列越長,雜質越難被分離。在早期,人們是通過聚丙烯酰胺凝膠電泳分離,通過UV來檢測;1980年,主要采用CGE分離不同長度的序列,這個方法主要是在聚丙烯酰胺凝膠電泳的基礎上,填加了毛細管,從而提高理論塔板數;陰離子交換(AEX)HPLC后來被廣泛應用,主要是用來定量分析硫磷二酯中的PO雜質;最近,離子對(IP)HPLC技術流行開來,在很多情況下,已經替代了CGE方法,用于分離不同長度序列的雜質;近年來,ESI-MS和IP-HPLC-ESI-MS技術被廣泛使用。
表2 雙鏈寡核苷酸活性成分的檢測項目和分析方法[7]
表3 單鏈寡核苷酸活性成分的檢測項目和分析方法[7]
遞送系統的挑戰
遞送系統是小核酸藥物研究的重點項目之一,遞送系統關系到藥物的安全性和有效性,對于不同疾病不同藥物類型可能千變萬化;目前已上市siRNA的產品均采用遞送系統,而目前已上市的ASO未采用遞送,但最終是否需采用遞送系統還是要考慮眾多因素;①作用靶點在哪些位置,腦部?肝?肺?肌肉組織?;②注射途徑是什么?③風險與收益的平衡;
比如海昶生物對治療原發性腎癌的HC0201進行了納米脂質體優化,形成了差異化創新的抗原發性肝癌藥物HC0301,兩者為同一核酸API Mychexin;HC0201通過納米脂質體技術,使它的穩定性和生物分布得到更佳的優化,同時對腫瘤內皮細胞和腫瘤微環境還有一些靶向的作用,通過遞送系統,使藥物精準作用肝臟,因此用于肝癌,而未采用遞送系統則是用于治療原發性腎癌。
又比如針對治療阿爾茨海默病(AD)和腦淀粉樣血管病(CAA)等疾病,這些疾病的病變部位主要是腦部,因此目前較為成熟的遞送手段LNP和GalNAc修飾手段,主要遞送至肝臟,無法達到腦部;Alnylam Pharmaceuticals所開發的C16偶聯技術經過優化,使得能夠到達中樞神經系統組織,在今年10月底,針對治療阿爾茨海默病(AD)和腦淀粉樣血管病(CAA),Alnylam公布了在研的ALN-APP產品,目前該產品臨床1期試驗的中期結果獲得了積極效果。結果顯示,單劑ALN-APP的持續藥代動力學活性可以長達10個月,同時觀察到與AD和CAA相關的淀樣蛋白片段Aβ42和Aβ40的顯著降低。
比如已上市的Golodirsen,主要是用于治療杜氏肌營養不良癥,該產品主要是通過PMO修飾,并未使用遞送系統,抗肌萎縮蛋白是一種細胞骨架蛋白主要布于心肌和骨豁肌肌纖維膜的胞質,最主要是分布在神經肌肉接頭處,而被修飾后的Golodirsen,通過靜脈注射,藥物可以與血漿蛋白結合,自動進入細胞內,而該蛋白是處于心肌與骨骼肌纖維膜的胞質中,即藥物僅進入外周組織即可達到效果。
圖片來源于海昶生物官網
ALN-APP顯著降低腦脊液中的Aβ42和Aβ40水平(圖片來源:Alnylam官網)
總結:
一個藥物被成功開發,最終走上市場需要經歷千錘百練,需要考慮的因素也是非常眾多;對于小核酸藥物CMC的研發要點遠遠不止于此,在這里僅僅是粗略談論了序列的設計思路、合成的研發要點、質量控制的研發要點、以及遞送系統需要考慮的要點。
參考文獻:
[1] DeVos, Sarah L.; Miller, Timothy M. (2013). Antisense Oligonucleotides: Treating Neurodegeneration at the Level of RNA. Neurotherapeutics, 10(3), 486–497. doi:10.1007/s13311-013-0194-5 ;
[2]Pourshahian, Soheil (2019). THERAPEUTIC OLIGONUCLEOTIDES, IMPURITIES, DEGRADANTS, AND THEIR CHARACTERIZATION BY MASS SPECTROMETRY. Mass Spectrometry Reviews, (), mas.21615–. doi:10.1002/mas.21615
[3] Comprehensive medicinal chemistry ,3rd.ed manufacturing of oligonucletides
[4] William F. Kiesman,Perspectives on the Designation of Oligonucleotide Starting Materials 10.1089/nat.2020.0909
[5] FDA發布指南草案:IND Submissions for Individualized Antisense Oligonucleotide Drug Products for Severely Debilitating or Life-Threatening Diseases: Chemistry, Manufacturing, and Controls Recommendations Guidance for Sponsor-Investigators
[6] Capaldi, Daniel; Teasdale, Andy; Henry, Scott; Akhtar, Nadim; den Besten, Cathaline; Gao-Sheridan, Samantha; Kretschmer, Matthias; Sharpe, Neal; Andrews, Ben; Burm, Brigitte; Foy, Jeffrey (2017). Impurities in Oligonucleotide Drug Substances and Drug Products. Nucleic Acid Therapeutics, (), nat.2017.0691–. doi:10.1089/nat.2017.0691
[7] Capaldi, D.; Ackley, K.; Brooks, D.; Carmody, J.; Draper, K.; Kambhampati, R.; Kretschmer, M.; Levin, D.; McArdle, J.; Noll, B.; Raghavachari, R.; Roymoulik, I.; Sharma, B. P.; Thurmer, R.; Wincott, F. (2012). Quality Aspects of Oligonucleotide Drug Development: Specifications for Active Pharmaceutical Ingredients. Therapeutic Innovation & Regulatory Science, 46(5), 611–626. doi:10.1177/0092861512445311