今日頭條
信立泰ETA受體拮抗劑獲批臨床。信立泰自主研發的小分子ETA受體拮抗劑SAL0120片的臨床試驗申請獲CDE受理,擬開發適應癥包括輕、中度原發性高血壓。SAL0120是通過選擇性拮抗ETA受體,在現有用藥基礎上達到進一步降低血壓的目的。目前,國內外尚無以原發性高血壓為適應癥的ETA受體拮抗劑上市銷售。SAL0120有望為原發性高血壓患者提供全新機制的降壓藥物。
國內藥訊
1.國產帶狀皰疹減毒活疫苗獲批上市。百克生物的帶狀皰疹減毒活疫苗獲國家藥監局批準上市,這是國內首款獲批的帶狀皰疹減毒活疫苗,適用于40歲及以上成人預防帶狀皰疹及其并發癥皰疹后神經痛。據估計,2030年中國帶狀皰疹疫苗市場規模將達到560億元,臨床需求巨大;百克帶狀皰疹疫苗將與葛蘭素史克重組帶狀皰疹疫苗Shingrix進一步爭奪國內市場。
2.恒瑞干眼癥1類新藥報產。恒瑞醫藥從Novaliq GmbH公司引進的SHR8058滴眼液上市申請獲國家藥監局受理,用于治療瞼板腺功能障礙相關干眼病。SHR8058由100%全氟己基辛烷組成,能迅速擴散至整個眼表,并與淚膜的親脂部分相互作用,覆蓋在淚膜水液層表面,穩定淚膜、防止淚液過度蒸發。在Ⅲ期臨床(SHR8058-301)中,與安慰劑相比,SHR8058顯著改善患者的干眼病癥狀和體征;且該滴眼液安全可靠,局部耐受性好。
3.羅氏CD20/CD3雙抗在華報產。羅氏格羅菲妥單抗(Glofitamab)的上市申請獲NMPA受理。Glofitamab是一款2:1型CD20/CD3靶向的T細胞雙特異性抗體,旨在引導T細胞參與并消除惡性B細胞。在II期NP30179擴展研究中,Glofitamab用于彌漫性大B細胞淋巴瘤(DLBCL)的治療達到完全緩解(CR)率為39.4%,總體緩解率ORR為51.6%。此前,Glofitamab已被CDE納入優先審評,擬用于治療復發或難治性DLBCL和原發性縱隔大B細胞淋巴瘤患者。
4.海創口服AR PROTAC在美獲批臨床。海創藥業自主研發的PROTAC藥物HP518獲FDA批準,即將在美國開展用于治療轉移性去勢抵抗性前列腺癌(mCRPC)的臨床試驗。HP518對野生型AR和恩扎盧胺耐藥的變異AR具有高降解活性,并對AR依賴的前列腺癌的細胞系具有優異的抑癌活性。目前,該新藥正在澳大利亞開展一項I期臨床,評估在mCRPC患者中的安全性與有效性。
5.君實降血脂siRNA療法報IND。君實生物1類化藥JS401注射液的臨床試驗申請獲CDE受理,擬用于治療混合型高脂血癥。JS401是該公司專有siRNA技術平臺開發的首個siRNA藥物,可長期有效針對混合型高脂血癥(具體未披露),有效降低靶點表達,抑制靶標蛋白。今年1月,君實生物公開了PCSK9 siRNA、ANGPTL3 siRNA專利。根據公開資料,推測JS401為ANGPTL3 siRNA。
國際藥訊
1.伊立替康脂質體聯合用藥Ⅲ期臨床積極。益普生在ASCO-GI2023會議上公布伊立替康脂質體注射劑Onivyde聯合NALIRIFOX化療方案(包含5-氟尿嘧啶/亞葉酸鈣、奧沙利鉑)一線治療轉移性胰腺導管腺癌(mPDAC)的Ⅲ期臨床(NAPOLI 3)積極結果。在中位隨訪16.1個月時,NALIRIFOX化療方案與活性對照組(吉西他濱與白蛋白紫杉醇組合療法)相比,患者的總生存期顯著提高(11.1個月vs9.2個月,p=0.04),無進展生存期達到7.4個月(vs5.6個月,p=0.0001),而且NALIRIFOX方案的安全性可控。
2.心臟病基因療法早期臨床積極。XyloCor公司基因療法XC001治療頑固性心絞痛的Ⅰ/Ⅱ期臨床結果積極。XC001旨在在心臟中特異性表達能夠促進血管增生的血管內皮生長因子(VEGF),從而促進心臟的血管生成。6個月的治療數據顯示,患者的缺血性癥狀顯著降低,幾乎半數受試者能夠在不產生心絞痛的情形下進行日常運動,沒有發現任何與藥物相關的安全性問題。
3.UniQure引進一款漸凍癥基因療法。UniQure公司與Apic Bio公司就后者臨床早期肌萎縮側索硬化(ALS)基因療法APB-102達成合作許可協議。APB-102是由重組腺相關病毒載體AAVrh10表達能對SOD1進行基因敲低的微RNA(miRNA)所組成,已獲得FDA批準可開展I/II期臨床試驗。根據協議,UniQure將獲得APB-102的全球開發與商業化權益;Apic Bio將獲得1000萬美元的預付款,最多達4500萬美元的潛在里程碑付款。
4.DLL3靶向CAR-T臨床前研究積極。Allogene Therapeutics公司基于單鏈可變片段(scFv)開發的靶向DLL3的同種異體CAR-T療法ALLO-213在針對小細胞肺癌(SCLC)的臨床前研究中獲積極結果。DLL3在腫瘤上高表達、在正常組織中表達有限,是SCLC和其他潛在實體瘤的有希望的靶標。臨床前研究結果顯示,ALLO-213能控制小鼠模型體內DLL3+腫瘤的生長,并且沒有正常組織毒性。
5.禮來Aβ單抗被FDA拒批。禮來制藥Aβ單抗Donanemab注射液用于治療早期癥狀性阿爾茨海默病(包括阿爾茨海默病所致的輕度認知障礙以及輕度阿爾茨海默病)的加速上市的申請收到FDA發送的完整回復函(CRL)。FDA表示:遞交上市申請所基于的臨床試驗中,接受至少12個月藥物治療的患者數量有限(至少為100名)。除此之外,FDA在完整回復函中未提及其它缺陷。
6.輝瑞2022年總收入1003億美元。輝瑞公布2022年財務報表,全年總營收創歷史新高,達到1003.3億美元,同比增長23%,成為全球首個年收入超千億美元的制藥企業。其中新冠疫苗Comirnaty和口服新冠藥物Paxlovid在2022年實現了567.39億美元的銷售收入,其他產品包括Eliquis(阿哌沙班,64.80億美元,+9%)、Prevnar family(63.37億美元,+20%)、Vyndaqel/Vyndamax(24.47億美元,+21%)、Inlyta(阿昔替尼,10.03億美元)、Xtandi(恩扎盧胺,11.98億美元,+1%)等業績也耀眼。
醫藥熱點
1.WHO宣布維持新冠全球緊急狀態。世衛組織30日發表聲明,宣布盡管新冠大流行可能正接近轉折點,但目前仍構成“國際關注的突發公共衛生事件”。因為與其他呼吸道傳染病相比,新冠導致的死亡人數仍然很高,且中低收入國家以及全球高風險群體的疫苗覆蓋率仍顯不足,在是否會出現新變種病毒方面仍有不確定性。世衛組織緊急委員會呼吁采取長期公共衛生行動,優先降低新冠發病率和死亡率。
2.國家骨科醫學中心在積水潭醫院掛牌成立。1月28日,國家骨科醫學中心在北京積水潭醫院掛牌成立,將建設成為國際一流骨科臨床診療中心和世界前沿的科技創新中心。國家骨科醫學中心以北京積水潭醫院、上海市第六人民醫院為主體,形成南北協同、優勢互補的模式,建立多中心協同工作機制,帶動全國骨科領域的建設與高質量發展。
3.先聲藥業新冠藥750元/盒。1月30日,北京市醫保局發布《新冠治療藥品先諾特韋片/利托那韋片組合包裝首發報價公示》,顯示海南先聲藥業新冠口服藥先諾特韋(20 片 *375 mg)/利托那韋(10 片 *100 mg)組合包裝(商品名為先諾欣®)的首發報價為 750元,計價單位為盒/療程。附件顯示,首發報價對照藥品主要為奈瑪特韋片/利托那韋片(Paxlovid)、莫諾拉韋膠囊(利卓瑞)和阿茲夫定片。在「療程費用比」信息欄中顯示,奈瑪特韋片/利托那韋片價格為1890元/療程,莫諾拉韋膠囊(利卓瑞)價格為1500元/療程,阿茲夫定片平均445元/療程,其中醫保納入后為350元/療程。
評審動態
1. CDE新藥受理情況(02月01日)
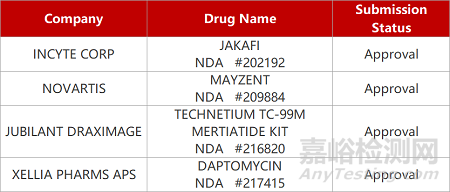
2. FDA新藥獲批情況(北美01月31日)