您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2022-05-06 15:00
溶出度是指藥物從制劑在規定介質中溶出的速度和程度,藥物只有從制劑中釋放出來,經過人體吸收進入血液循環后,才能發揮藥效。因此,溶出度不僅是制劑質量控制的重要指標,更是藥品有效性的內在保證。《中國藥典》2020年版四部0931通則即溶出度與釋放度測定法共收載了7種溶出測定方法,分別為籃法、槳法、小杯法、槳碟法、轉筒法、流池法、往復筒法。其中流池法為新增溶出度測定法。除此之外,美國藥典、歐洲藥典及日本藥局方均已收載流池法。
01流池法基本結構及工作原理
《中國藥典》2020年版對流池法的形狀結構及各項參數均做出詳細規定,如流通池尺寸、內徑、標準流速及脈沖頻率等。詳細參數見圖1(來源于《中國藥典》2020年版)。流通池中各部件位置均已固定,幾乎不需要機械校正,使用及維護較為簡單。作為一種新型的溶出度測定方法,流池法的工作原理為使用恒流泵將溶出介質以適宜流速泵入流通池中與待測樣品接觸,通過介質的流動來溶解樣品,樣品溶液經流通池上端過濾后流出,測定按照預設時間點或時間段收集的樣品溶液中的藥物濃度。
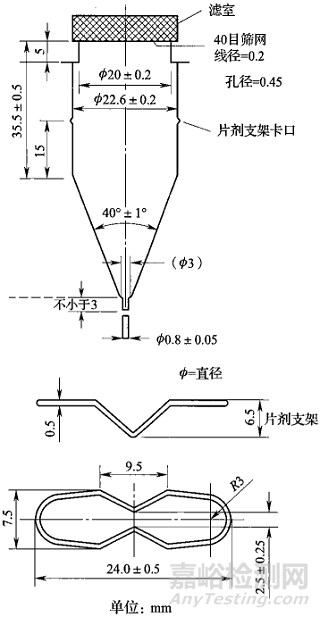

圖1 用于片劑及膠囊劑的大流通池(左)及小流通池(右)
影響流池法溶出儀的重要因素主要有輸液泵、流速曲線及過濾系統。
目前流通池系統常用兩種輸液泵即陶瓷活塞泵和玻璃管雙通道注射泵。陶瓷活塞泵的優點是無閥體,耐磨損無耗材穩定耐用,尤其適合長效制劑,活塞泵內置自動校驗模式可方便快速校驗泵的流速,從而保證實驗結果的準確性和重現性;且可每個泵運行不同的流速,大大提高研發效率。而玻璃管雙通道注射泵使用的是塑料密封圈,不耐磨損,高頻使用下密封圈易磨損出現密封性不好、漏液和流速不準等問題。深圳市華溶分析儀器有限公司是國內首家將活塞泵流池法溶出儀系統商品化的公司。
各國藥典中都規定流速曲線應為正弦曲線。活塞泵從原理和設計上天然地可實現正弦流速曲線。雙通道注射泵最初設計是實現無脈沖曲線,通過軟件的計算模擬理論上能實現正弦曲線,而實際操作較難控制和實現正弦曲線,會經常出現三角脈沖曲線或梯形脈沖曲線。華溶流池法采用活塞泵可實現開閉環自動切換設計,并可進行正弦流速曲線的驗證。
此外,華溶流池法具有多重過濾系統,確保樣品的不溶顆粒被逐級過濾,且可以降低系統壓力,還配有七個壓力傳感器,可實時監控池體壓力并預測流速的準確性;當出現高壓報警時,泵停止運轉以保護活塞泵,實驗過程中實時記錄各個池體的壓力變化曲線,可通過分析壓力曲線分析制劑溶出過程和溶出結果。
02流池法的優點
根據溶出介質是否循環可將流池法系統分為閉環式系統和開環式系統。閉環式流通池系統(圖2)中的溶出介質流過流通池后再返回溶出介質庫,與傳統溶出方法相似,溶出介質體積固定,藥物溶出濃度隨時間的增加而增大,直至溶出介質中藥物濃度不再改變。該方法解決了槳法中待測樣品的黏附、漂浮或堆積等難題,適合介質量較少且不易檢測的藥物釋放度的測定,不僅適用于片劑、膠囊劑、顆粒劑等傳統劑型,還可應用于混懸劑、骨架片、納米粒、微球、栓劑等多種新型遞藥系統。

圖2 閉合式流通池系統示意圖
開環式流通池系統(圖3)中的溶出介質流過流通池后不再返回,保證了被測樣品時刻暴露于新鮮的溶出介質中,始終維持漏槽條件,在不引入增溶劑下可以滿足難溶性藥物的溶出測定,適合需要大量溶出介質的實驗。開環式系統配有溶媒選擇器,可在實驗過程中自動切換至不同pH的溶媒,用于模擬胃腸道pH變化的環境。目前,已上市藥物中40%為BCS二類和四類藥物,開發中的新型藥物分子中有90%為BCS二類和四類藥物即低溶解度高滲透性藥物。因此,開環式流池法對新藥開發意義重大。除上述優點外,流池法較傳統的籃法及槳法具有更緩和的流體動力學性質,可以一定程度上區分由于溶出過快而體現不出差異的樣品。此外,流池法的載樣方式更為靈活,投藥位置相對固定,極大地提高了實驗的重現性。

圖3 開放式流通池系統示意圖
體內外相關性表示制劑體外特征(如藥物釋放曲線)與其體內性能(如血藥濃度-時間曲線)之間的數學關系,目的是使用體外溶出數據預測藥物的體內血藥濃度-時間曲線。研究者使用經過驗證的體內外相關性來獲得生物等效豁免,即通過使用溶出試驗來替代體內生物等效性試驗,從而在產品開發和藥品整個生命周期中節省時間和成本,具有重要意義。流池法不僅可以實現介質pH種類、用量及流速的調節,從而模擬人體消化道的pH環境及消化液體積的變化,還可以在池底放置玻璃珠,以此來改變介質流動方式,模擬有無食物狀態及不同年齡、不同病理條件下患者的胃腸蠕動情況,從而更準確地反映藥物在體內的轉運過程及藥物的作用特點,適用于體內外相關性研究。
03流池法在新型遞藥系統中的應用
微球
Zolnik等人比較流池法及傳統溶出方法測定地塞米松微球溶出度的差異,研究發現流池法大大減少了聚合微球的損失[1]。
梁苑英竹等人分別采用轉瓶法及流池法研究注射用醋酸奧曲肽微球體內外釋放度[2]。圖2為樣品體內-體外加速釋放相關性結果。研究表明采用流池法測定的體外加速釋放快于轉瓶法,且與體內釋放具有良好的相關性(R>0.96),為評價奧曲肽微球的體內外釋放提供了參考。


圖2 流池法測定的樣品A和B體內-體外加速釋放相關性
滲透泵片
滲透泵片是由藥物、半透膜材料、滲透壓活性物質和推動劑等組成,以滲透壓作為釋藥能源的控釋片,其基本結構是先將藥物與適宜輔料壓制成片芯,外包一層半透性物質膜,后用激光在膜上打一小孔。胃腸道水分透過半透膜進入片芯使藥物溶解,產生滲透壓,可透過半透膜使水分源源不斷地進入片芯。由于半透膜內容積的限制,藥物的近飽和濃度溶液又不斷地通過激光孔移向片外,這樣就使藥物以恒定的速率釋放到片外,因此稱為滲透泵。
Emara等利用流池法研究雙氯芬酸鈉滲透泵片的體外釋放行為,結果可以區分出不同輔料制備的滲透泵的釋放速率上的差異,表明流池法可以從釋放度這一關鍵質量屬性為處方篩選提供新的研究思路[3]。
脂質納米粒
脂質納米粒是以具有生物相容性的脂質材料為載體,將活性藥物溶解或包裹于脂質核或吸附于納米粒子表面的新型載藥系統。脂質納米粒具有改善藥物吸收、改變藥物體內吸收過程、提高穩定性、增效減毒等優勢,同時在生物體內或貯存過程中均穩定,現已廣泛應用于基因藥物、抗癌藥及多肽藥物等。脂質納米粒根據結構及載藥機制的不同可分為固體脂質納米粒、納米結構脂質載體。脂質-藥物共軛物、合物脂質雜化納米粒等。
Desmond Heng等人采用槳法、籃法及流池法測定并比較頭孢呋辛酯納米粒的溶出速率[4]。結果顯示通過流池法、籃法和槳法三種方法測定的納米粒與未加工的納米粒子的溶出比率分別為6.95、1.57和1.00,而模型預測值為7.97。以上數據表明流池法能夠反映藥物的真實溶出程度,是測定納米粒溶出特性的最適宜方法。
此外,Lucas等發現相比于籃法,流池法可以更好的測定載藥納米粒的溶出速率和溶解程度[5]。
04展 望
現代評價藥物釋放度的方法越來越向著模擬人體內環境的方向發展,具有較高體內體外相關性的方法成為人們選擇測定藥物釋放度的一個重要選擇。流池法作為一種新型的溶出度測定方法,順應了這一發展趨勢,在適用范圍及適用性等方面極大地彌補了傳統釋放度方法的不足,在制劑處方設計研究和質量控制方面具備十分廣闊的應用前景。
參考文獻
[1] ZOLNIK B S 等. Application of USP apparatus 4 and in situ fiber optic analysis to microsphere release testing.
[2] 梁苑英竹等. 注射用醋酸奧曲肽微球體內外釋放度分析.
[3] EMARA.Development of an osmotic pump system for controlled delivery of diclofenac sodium.
[4] What is a suitable dissolution method for drug nanoparticles?
[5] Lucas Sievens-Figueroa. Using USP I and USP IV for discriminating dissolution rates of nano- and microparticle-loaded pharmaceutical strip-films.

來源:藥事縱橫


