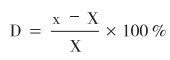摘要:
目的:評價參與能力驗證實驗室的鎘元素殘留量測定能力,提高殘留檢測質量水平。
方法:根據CNAS相關文件要求,對制備的能力驗證用金銀花樣品進行均勻性和穩定性檢驗,以參加實驗室檢測結果的中位值為指定值,采用實驗室的檢測結果與指定值的百分相對差(D)對能力驗證結果進行統計分析,評價標準:|D|≤ 16%,評價結果為"滿意";|D|>16%,評價結果為"不滿意"。
結果:在252家參加實驗室中,有249家實驗室按要求提交有效數據,滿意率為94.4%,不滿意率為5.6%。結論:大多數參加實驗室對標準的執行能力和質量保障體系均比較良好。根據收集到的信息,對于產生偏離的原因,從總體上對共性問題進行技術分析,并給出相關的技術建議,有助于提升參加實驗室的檢驗能力。
能力驗證(proficiency testing,PT)是指利用實驗室間比對,按照預先制定的準則評價參加者的能力[1-2]。近年來,隨著CNAS對藥品分析領域能力驗證活動越來越多的關注,重金屬及有害元素殘留分析作為保證中藥質量安全的重要檢測項目,顯得尤為重要。重金屬及有害元素為公認的環境污染物,是影響食品藥品安全性的主要因素之一[3-4]。鎘為已知的肯定致癌物,也是毒性最強的重金屬元素之一[5-6]。為了增加殘留檢測實驗室間的技術交流,提高檢測質量水平,按照實驗室認可和實驗室資質認可的有關要求,中國食品藥品檢定研究院組織實施NIFDC-PT-141金銀花中鎘元素殘留量測定能力驗證計劃,該計劃作為日常監督檢查的輔助手段,旨在有效提升實驗室的檢測能力,促使參加實驗室保持有效準確的檢測結果,同時幫助部分實驗室及時發現自身的不足并加以改進。
金銀花為常用中藥,也是藥食兩用品種,由于種植過程中的環境影響,有可能造成重金屬超標,在食品和藥品方面均需對其重金屬及有害元素殘留進行評估,對其安全性控制具有重要意義。《中國藥典》自2010年版開始,在金銀花項下規定“重金屬及有害元素”檢查項[7],其中鎘限量為0.3 mg·kg-1。目前,《中國藥典》品種檢查項下重金屬及有害元素以植物藥居多,因此金銀花樣品基質具有代表性,可作為考察樣品前處理過程中遇到問題時的解決手段(如預消解等);此外,金銀花樣品易得到,并且粉末流動性好,吸濕性差,由此可以得到均勻的PT樣品。
NIFDC-PT-141計劃是依據ISO/IEC 17043:2010 《合格評定能力驗證的通用要求》運作實施的能力驗證計劃,主要提供全國相關實驗室參加藥品檢測能力驗證的機會,面向各級食品藥品檢驗機構、相關藥品生產企業和第三方實驗室等,參加者自愿報名。本研究主要對NIFDC-PT-141能力驗證樣品前處理及檢測方法、測定結果等方面進行整合,根據收集到的信息,對于產生偏離的原因,從總體上對共性問題進行技術分析,并給出相關的技術建議,以便參加者正確認識檢驗過程中存在的問題,提升檢驗能力。
1 方法
1.1 PT樣品制備
本次能力驗證計劃采用單水平設計,向每個參加實驗室發放1個目標樣品。取金銀花藥材,粉碎,過四號篩,以固相勻質機混合2小時,使其均勻,得到黃綠色的粉末。采用聚乙烯小瓶包裝,每瓶樣品裝量約為50 g,常溫儲藏。按照預定的編碼順序進行編碼和張貼標簽。
1.2 PT樣品均勻性和穩定性檢驗
1.2.1 均勻性檢驗
隨機抽取本次能力驗證樣品15瓶,按照《中國藥典》2015年版一部“金銀花”項下“重金屬及有害元素”項規定的方法進行測定,每瓶樣品在重復條件下測定3次。采用單因素方差(F檢驗法)進行分析,F<自由度為(f1,f2)及顯著性水平α=0.05的臨界值Fα(f1,f2),表明樣品之間無顯著性差異,樣品是均勻的。
1.2.2 穩定性檢驗
隨機抽取包裝箱內的樣品4瓶,按照《中國藥典》2015年版一部“金銀花”項下“重金屬及有害元素”項規定的方法進行測定,分別于0、1、2、3、8月進行測定。采用t檢驗評價樣品分別在第1、2、3、8月與第0月測定結果的一致性,當t<t0.05,(自由度)時,表明樣品穩定。
1.3 檢測方法
NIFDC-PT-141能力驗證試驗考慮到各實驗室儀器配備及檢驗能力的差異,沒有規定統一的檢測方法。推薦各實驗室按照《中國藥典》2015年版一部“金銀花”項下“重金屬及有害元素”項規定的方法對樣品進行檢測,也可采用其他經過驗證的包含原子吸收分光光度法、電感耦合等離子體質譜法的標準方法進行檢測。但是試劑盒、X射線熒光等快檢方法獲得的測試結果不予采納。
1.4 統計分析方法
按照《能力驗證的選擇核查與利用指南》(CNAS-GL40)和《能力驗證結果的統計處理和能力評價指南》(CNAS-GL02)等文件的要求[8-10],本次能力驗證取參加實驗室檢測結果的中位值為指定值,采用實驗室的檢測結果與指定值的百分相對差為本次能力驗證結果統計分析方法,計算公式如下:
公式中x為參加實驗室的測定值;X為指定值,得到的百分相對差D應符合預定要求。
1.5 評價原則
參照《中國藥典》2015年版四部通則9101指導原則中對重現性數據的要求,確定本次能力驗證結果判定原則為:|D|≤16%,評價結果為“滿意”;|D|>16 %,評價結果為“不滿意”。
2 結果與分析
2.1 均勻性檢驗結果
按照單因素方差分析方法[11],采用Excel表格將均勻性測定結果進行計算,結果見表 1,F值等于1.18,小于顯著性水平α=0.05的臨界值2.03,表明樣品瓶間與瓶內之間無顯著性差異,樣品是均勻的。
表 1 均勻性檢驗結果
2.2 穩定性檢驗結果
按照t檢驗分析方法[11],采用Excel表格將穩定性測定結果進行計算,樣品分別在第1、2、3、8月與第0月測定結果的t值分別為0.09、1.84、0.34、0.34,均小于t0.05(44)=2.02,檢驗結果趨勢見圖 1,結果表明本品在8個月內穩定。
圖 1 穩定性檢驗結果
2.3 參加實驗室情況
參加本次能力驗證的實驗室共有252家,分布于全國除港、澳、臺外的31個省(自治區)、直轄市,主要包括各級食品藥品檢驗機構、醫療器械檢驗所、藥品生產企業及其他科研單位和實驗室。其中各級食品藥品檢驗機構和醫療器械檢驗所185家(占總參加實驗室的73%);企業QC實驗室19家(占總參加實驗室的8%);其他科研單位和實驗室48家(占總參加實驗室的19%)。
2.4 能力驗證結果
在252家參加實驗室中,有249家實驗室按要求提交了結果報告,經統計分析,本次能力驗證檢測結果不成正態分布,中位值為0.214 mg·kg-1。根據評價原則,其中2 3 7家實驗室的檢測結果為“滿意”(|D|≤16%);結果為“不滿意”(|D|>16%)的實驗室為12家,其中地市(縣區)級食品藥品檢驗機構6家,分別位于黑龍江、遼寧、甘肅、云南、山西和山東,藥品生產和檢驗檢測企業及第三方檢測機構6家。另外,根據作業指導書要求,對于沒有上報能力驗證結果的2家實驗室,評價結果均為“不滿意”;1家實驗室申請退出,不做評價。圖 2為參加實驗室百分相對差面積圖,總體來看,滿意率為94.4%,不滿意率為5.6%。
圖 2 百分相對差面積圖
2.5 技術分析
2.5.1 鎘元素對照品差異分析
本次能力驗證實驗沒有向參加單位統一提供標準品。目前,中國食品藥品檢定研究院已開始發放鉛鎘砷汞銅混合標準品溶液,由統計結果可知,各實驗室標準物質主要來源于中國計量科學研究院、國家有色金屬及電子材料分析試劑中心、國家鋼鐵材料測試中心鋼鐵研究總院等單位,也有部分標準品購自國外公司。具體信息見表 2。不同來源的標準物質,對測定結果沒有表現出明顯差異,但從各單位提供的原始記錄中反映出如下問題應引起注意:①建議首選合法的標準物質;②所選用的標準物質應在效期以內,1μg·mL-1以下濃度對照溶液必須臨用新配;③殘留檢測中,一般均須使用標準物質貯備溶液,多數檢驗記錄中缺乏貯備溶液的配制日期及保存條件等信息。
表 2 鎘元素對照品信息
2.5.2 檢測方法及使用標準
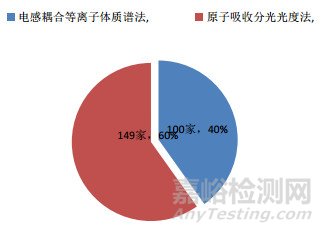
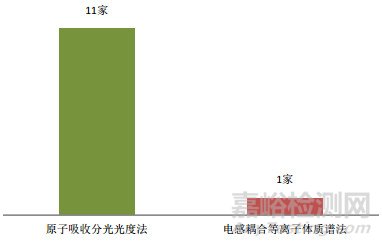
從結果報告的原始記錄中統計,本次能力驗證試驗檢測方法涉及原子吸收法(AAS)和電感耦合等離子體質譜法(ICP-MS),統計結果見圖 3。本次能力驗證參加單位采用的標準經統計,主要涉及3個標準:《中國藥典》2015年版一部、國標食品方法GB 5009.15-2014、香港中成藥注冊安全性資料技術指引,統計結果見圖 4。另外,兩種檢測方法中涉及的不滿意實驗室數量統計見圖 5。
圖 3 檢測方法
圖 4 檢驗標準
圖 5 不滿意實驗室數量
對上述統計結果分析如下:
1)檢測方法的選擇。參加單位中,其中使用AAS法149家,占上報結果實驗室的60%;使用ICP-MS法100家,占上報結果實驗室的40%。從統計中可見,AAS法仍被絕大多數單位采用,為目前藥品檢驗行業進行重金屬及有害元素殘留檢測的主要方法。
2)檢測標準的選擇。參加單位中,其中有229家單位采用《中國藥典》2015年版一部標準,19家單位采用GB 5009.15-2014標準,1家單位采用香港中成藥注冊安全性資料技術指引。因金銀花屬于藥食兩用品種,采用食品和藥品檢測方法均可,由參加者反饋的結果報告可以看出,3個標準方法差異并不大。
3)不同方法能力驗證試驗結果比較。采用ICP-MS法的實驗室中,有1家實驗室結果不滿意,占ICP-MS法的實驗室1%;采用AAS法的實驗室中,有11家實驗室數據不滿意,占AAS法的實驗室7%。上述數據表明,采用ICP-MS法的實驗室結果不滿意率較低,而采用AAS法的實驗室結果不滿意率相對較高,從技術角度分析,由于檢測原理不同,兩種方法對環境的要求也不一樣,在檢測過程中不同檢驗人員的操作存在一定的偏差。
4)不同方法能力驗證數據比較。對鎘元素測定所有報送結果,按照不同分析方法分別統計平均值及相對標準偏差,統計后的平均值均為0.215 mg·kg-1,偏差為0.001%,結果表明鎘元素檢測結果平均值沒有明顯差異,誤差也較小。
上述分析表明AAS、ICP-MS法均是中藥中重金屬和有害元素殘留測定可供選擇的方法,方法的差異對結果離散的作用較小。AAS法為經典方法,適用性廣,檢測成本適中,為多數實驗室所采用。ICP-MS法為目前元素分析領域最先進的方法,具有多元素同時測定高效率、高靈敏度的特點。
5)檢測條件的優化。本次能力驗證試驗中,經檢查原始記錄表明,一些實驗室采用的測定條件簡單套用儀器推薦條件,缺乏系統優化,整個試驗過程中缺乏分析質量保證體系。這些問題提示我們先進的儀器只是必要的檢測基礎,專業人員的培養和科學合理的操作規程、質控體系更應成為殘留分析獲得滿意結果的關鍵。
2.5.3 樣品的前處理
重金屬與有害元素檢測中,樣品需進行酸消解處理,破壞基質,使待測元素游離,并減少測定時的背景干擾。消解方式主要包括微波消解、干法消解、濕法消解等。約95%的參加單位選擇了微波消解方式進行樣品處理,另有9家單位采用濕法消解,還有3家單位采用了干法消解,詳見圖 6。微波消解具有高效率、空白干擾低、待測元素損失少,回收率高的特點,《中國藥典》將其列為第一法。
點擊查看原圖
圖 6 樣品前處理方法使用統計
微波消解法中,一般消解溫度為最主要的參數,通常設定2~3個溫度水平,各消解3~10分鐘。不同品牌的微波消解儀,功率不同,控溫方式也有差異;針對不同的中藥樣品,消解程序可能也有不同,因此難以給出一致的最佳消解程序,需各單位在實際工作中積累經驗,試驗后設定。消解用酸的選擇是影響消解效果的另一個重要因素,多數單位采用單一的硝酸作為消解用酸,針對金銀花樣品,硝酸可以滿足消解要求,但其他較難消解的中藥樣品,可能需要采用硝酸-鹽酸、硝酸-高氯酸、硝酸-過氧化氫等體系,提高消解能力。當消解中采用硝酸-高氯酸、硝酸-過氧化氫等體系時,由于氧化能力大幅增強,建議采用預消化等方式,避免由于劇烈反應造成的安全隱患。
消解后的樣品,通常需要趕酸。趕酸溫度一般不得高于130℃,否則易揮發的元素可能有損失。趕酸至少應至紅棕色蒸氣揮盡,采用AAS作為檢測方法時,趕酸應盡可能完全,否則供試品溶液中高濃度的硝酸可能是測定中背景干擾的重要來源。供試品經過消解、趕酸、以水稀釋定容后,應為無色或淺黃綠色澄明溶液,顏色較深或有混濁情況,通常代表著樣品消解不完全,可能對測定結果帶來無法預計的影響。
濕法消解與干法消解也是破壞植物藥材有機基體的有效手段,是較常用的兩種消化方式。兩種方法也有優缺點,濕法消解在于適用性強、樣品取樣量可以較大,揮發損失或附著損失較小,其缺點是試劑用量大,空白值往往較高,處理所需時間較長;干法消解能取較大量的樣品供測試,方法簡便,試劑污染小,空白值低,其不足之處是較高的灰化溫度容易造成揮發性元素的損失,使測定結果偏低[12]。
2.5.4 分析過程的質量控制
重金屬及有害元素殘留分析屬于痕量分析范疇,由于待測成分通常處于極低含量水平,試劑、水、環境等對測定可能產生難以預計的影響,系統誤差及偶然誤差都不能忽視。殘留分析區別于常規的常量分析、微量分析的最重要一點是在整個分析過程中,必須隨行分析質量控制程序,以保證結果的可靠[13]。在重金屬及有害元素殘留分析中,這些程序主要包括:線性范圍與校準曲線、隨行回收(或隨行工作對照)、空白對照、檢測限與報告限、分析誤差允許范圍、結果報告格式等。
對本次能力驗證試驗各實驗室采取的分析質量控制措施進行了初步統計。所有參加實驗室均制備并測定了隨行空白,有部分實驗室采用楊樹葉、茶樹葉等標準物質作為隨行工作對照,部分實驗室進行了隨行回收試驗,大部分實驗室同時進行了隨行工作對照和隨行回收試驗。目前,在我國,中國計量科學研究院可提供多種一級標準物質作為元素分析用工作對照物,主要有楊樹葉、茶樹葉、灌木葉、黃芪、人參等[14]。對工作對照物進行分析是一種簡便、有效的質量控制方法。
歐盟及美國等發達國家,對殘留分析都有嚴格而細致的技術要求,對殘留分析過程進行嚴格質量控制,是保證結果準確可靠的關鍵措施,也是世界各國殘留分析工作者通過多年工作經驗積累達成的共識。中國食品藥品檢定研究院已發布了《中藥中有害物質痕量殘留檢測分析質量控制指導原則》,可供殘留檢測分析工作者參考。
3 結論
中藥中的外源性有害殘留物嚴重影響藥用安全,以《中國藥典》為代表的藥品標準對有害殘留物的規定日益嚴格,我國的檢測工作相對而言處于逐步發展階段。重金屬有害元素殘留檢測是一個逐漸認識的過程,本次能力驗證反映出近幾年來藥檢系統各實驗室對重金屬及有害元素殘留檢測工作都高度重視,在硬件建設方面和質量管理方面已有了巨大投入,在省級、口岸所層面普遍具備了相應檢驗條件,藥典標準的執行能力和質量保障體系均比較滿意。在參加能力驗證并上報結果的249家實驗室中,所有檢測結果均為滿意的實驗室共237家,占全部參加能力驗證實驗室數量的94.4%。但從本次能力驗證所反饋的信息上看,也有部分單位在人員培訓、技術操作和結果分析、質量保證體系等方面存在一些薄弱環節,對這些單位在殘留檢測方面的檢驗能力建設我們將繼續關注。