您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2025-08-26 12:36
近日,江蘇暢醫達醫療科技有限公司研發的“顱內動脈瘤輔助栓塞支架”獲批上市,下面嘉峪檢測網與您一起了解一下該產品在臨床前研發階段做了哪些實驗。
一、顱內動脈瘤輔助栓塞支架的結構與組成
該產品由顱內支架、輸送元件組成,部分規格含有輸送導管。其中,輸送元件由輸送桿和導入鞘組成;輸送導管由微導管和塑形針組成。產品以無菌狀態提供,經環氧乙烷滅菌,一次性使用,貨架有效期3年。
二、顱內動脈瘤輔助栓塞支架的適用范圍
該產品適用于≥18歲的顱內動脈瘤患者,輔助彈簧圈治療囊狀寬頸(瘤頸≥4mm或瘤體/瘤頸比<2)動脈瘤,動脈瘤位于前循環(頸內動脈、大腦中動脈M1/M2段、前交通動脈、大腦前動脈),載瘤血管直徑≥2.0mm且≤5.2mm。
三、顱內動脈瘤輔助栓塞支架的工作原理
該產品為自擴張血管支架系統,用于輔助彈簧圈栓塞治療顱內動脈瘤。支架釋放后緊貼血管內壁封堵動脈瘤的瘤口,防止彈簧圈移位或脫落至正常血管及分支血管內。
四、顱內動脈瘤輔助栓塞支架的性能研究
產品技術要求研究項目包括:
1、支架:支架外觀、支架尺寸、局部擠壓、支架網孔密度、支架金屬覆蓋率、支架短縮率、相變溫度、支架耐腐蝕、彎曲打折、徑向支撐力;
2、輸送元件:輸送桿外觀、輸送桿尺寸、輸送桿的耐腐蝕性、輸送桿峰值拉力、輸送桿彎曲性能、輸送桿破裂性能、導入鞘尺寸、導入鞘峰值拉力、導入鞘外觀、導入鞘配合性能;
產品性能研究包括支架物理和機械性能、模擬使用性能、疲勞性能、有限元分析、MRI兼容性等。
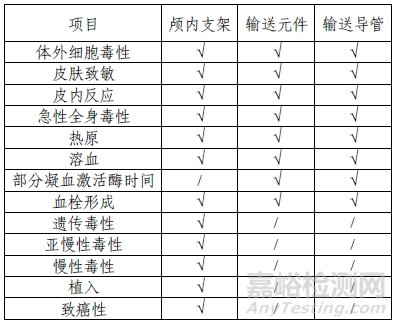
五、顱內動脈瘤輔助栓塞支架的生物相容性研究
產品由顱內支架和輸送元件組成,部分規格含有輸送導管。顱內支架為植入器械,與循環血液長期接觸;輸送元件和輸送導管為外部接入器械,與循環血液短期接觸;暢醫達對植入器械及外部接入器械分別進行了生物相容性評價。
生物相容性評價內容表
六、顱內動脈瘤輔助栓塞支架的滅菌
產品采用環氧乙烷滅菌,無菌狀態提供。滅菌確認報告證明無菌保證水平達10??,并對殘留毒性進行了研究。
七、顱內動脈瘤輔助栓塞支架的有效期和包裝研究
產品貨架有效期為3年。暢醫達通過加速老化和實時老化驗證,包括產品穩定性、包裝完整性和模擬運輸驗證,確保產品在有效期內性能符合要求。
八、顱內動脈瘤輔助栓塞支架的動物研究
該研究目的為評價顱內動脈瘤輔助栓塞支架在新西蘭大白兔動脈瘤模型中的有效性、安全性和可操作性。植入后30天、90天、180天分別進行觀察,評估動脈瘤治療效果和對血管組織的影響等。評價指標包括:

來源:嘉峪檢測網


