您當(dāng)前的位置:檢測(cè)資訊 > 實(shí)驗(yàn)管理
嘉峪檢測(cè)網(wǎng) 2025-07-18 20:49
摘 要: 建立測(cè)定七味糖脈舒膠囊中人參皂苷Rb1含量的高效液相色譜檢測(cè)方法。采用EC-C18色譜柱(100 mm×4.6 mm,2.7 μm),以乙腈-水為流動(dòng)相進(jìn)行梯度洗脫,流量為1.0 mL/min,檢測(cè)波長(zhǎng)為203 nm,柱溫為30 ℃,進(jìn)樣體積為10 μL。人參皂苷Rb1的質(zhì)量濃度在15.05~300.99 μg/mL范圍內(nèi)與色譜峰面積線性關(guān)系良好,相關(guān)系數(shù)為0.999 9,檢出限為0.000 430 mg/g,定量限0.001 08 mg/g。樣品加標(biāo)平均回收率為98.97%,測(cè)定結(jié)果的相對(duì)標(biāo)準(zhǔn)偏差為1.90%(n=6)。該方法操作簡(jiǎn)單,可用于七味糖脈舒膠囊中人參皂苷Rb1的含量測(cè)定。
關(guān)鍵詞: 七味糖脈舒膠囊; 人參皂苷Rb1; 高效液相色譜法
七味糖脈舒膠囊由黃芪、紅參、五味子、地黃、蜂膠、芹菜子和芫荽7味中藥材組成,具有補(bǔ)氣滋陰、生津止渴的功效,臨床上用于氣陰不足所致的消渴,證見(jiàn)口渴消瘦、疲乏無(wú)力及2型糖尿病見(jiàn)上述癥候者[1]。七味糖脈舒膠囊的現(xiàn)行質(zhì)量標(biāo)準(zhǔn)為國(guó)家藥品監(jiān)督管理局國(guó)家藥品標(biāo)準(zhǔn)WS-10479 (ZD-0479)-2002-2012Z,該標(biāo)準(zhǔn)僅對(duì)組方中黃芪甲苷進(jìn)行測(cè)定。七味糖脈舒膠囊的配伍成分中,黃芪補(bǔ)氣升陽(yáng)、固表止汗、生津養(yǎng)血,紅參大補(bǔ)元?dú)狻?fù)脈固脫、益氣攝血,二者合為君藥[1]。紅參既是君藥又是貴細(xì)藥材,現(xiàn)代研究表明,紅參藥材中的皂苷類、揮發(fā)油類、氨基酸類、糖類等,具有增強(qiáng)免疫、抗糖尿病、抗氧化等作用[2?6],同時(shí),紅參對(duì)糖尿病患者的視網(wǎng)膜具有保護(hù)作用[7?10]。基于紅參在七味糖脈舒膠囊中的地位和作用,對(duì)其含量進(jìn)行控制,將有利于藥品的質(zhì)量控制,確保藥品的有效性。采用高效液相色譜(HPLC)法測(cè)定紅參中人參皂苷含量的方法已有文獻(xiàn)報(bào)道[11?17],在測(cè)定過(guò)程中,雖然采用梯度洗脫的方式,但檢測(cè)時(shí)間較長(zhǎng)、成本較高,同時(shí)由于中成藥處方、工藝差異較大,無(wú)法直接用于七味糖脈舒膠囊中人參皂苷Rb1的測(cè)定。筆者通過(guò)對(duì)色譜條件的摸索和樣品處理?xiàng)l件的優(yōu)化,建立了測(cè)定七味糖脈舒膠囊中人參皂苷Rb1的HPLC法,可為七味糖脈舒膠囊質(zhì)量標(biāo)準(zhǔn)的制定提供參考。
1 實(shí)驗(yàn)部分
1.1 主要儀器與試劑
高效液相色譜儀:1260型,美國(guó)安捷倫科技有限公司。
電子天平:SECURA225D-1CN型,感量為0.01 mg,賽多利斯科學(xué)儀器(北京)有限公司。
甲醇:色譜純,德國(guó)默克公司。
乙腈:色譜純,上海星科高純?nèi)軇┯邢薰尽?/span>
正丁醇:分析純,利安隆博華(天津)醫(yī)藥化學(xué)有限公司。
三氯甲烷:分析純,四川西隴科學(xué)有限公司。
氫氧化鈉:分析純,國(guó)藥集團(tuán)化學(xué)試劑有限公司。
人參皂苷Rb1對(duì)照品:純度(質(zhì)量分?jǐn)?shù))為93.8%,批號(hào)為110704-202331,中國(guó)食品藥品檢定研究院。
七味糖脈舒膠囊樣品:批號(hào)分別為231102、231103、231104,昆明龍津藥業(yè)股份有限公司。
1.2 色譜條件
色譜柱:Agilent InfinityLab Poroshell 120 EC-C18柱(100 mm×4.6 mm,2.7 μm,美國(guó)安捷倫科技有限公司);流動(dòng)相:流動(dòng)相A為水,流動(dòng)相B為乙腈,流量為1.0 mL/min;洗脫方式:梯度洗脫,洗脫程序見(jiàn)表1;檢測(cè)波長(zhǎng):203 nm;柱溫:30 ℃;進(jìn)樣體積:10 μL。
表1 梯度洗脫程序
Tab. 1 Gradient elution program

1.3 溶液配制
70%甲醇溶液:量取甲醇700 mL,加純化水至總體積為1 000 mL,搖勻,此溶液作為空白溶液。
人參皂苷Rb1標(biāo)準(zhǔn)貯備液:取人參皂苷Rb1對(duì)照品適量,精密稱定,加入70%甲醇溶液制成質(zhì)量濃度為1.5 mg/mL的貯備液。
人參皂苷Rb1系列標(biāo)準(zhǔn)工作溶液:精密量取人參皂苷Rb1對(duì)照品貯備液各1 mL,分別置于100、50、20、10 mL容量瓶中,精密量取人參皂苷Rb1對(duì)照品貯備液3、2 mL,分別置于20、10 mL容量瓶中,用70%甲醇溶液稀釋至標(biāo)線,搖勻,制備成質(zhì)量濃度分別為15.05、30.10、75.25、150.50、225.74、300.99 μg/mL的系列標(biāo)準(zhǔn)工作溶液。
1.4 樣品處理
取出七味糖脈舒膠囊內(nèi)容物,研細(xì),取7.0 g,精密稱定,置于具塞錐形瓶中,精密加入甲醇50 mL,密塞,稱定質(zhì)量,加熱回流1 h。冷卻至室溫,再稱定質(zhì)量,用甲醇補(bǔ)足減失的質(zhì)量,搖勻,離心,精密量取上清液25 mL,蒸干,殘?jiān)尤?0 mL水溶解,用三氯甲烷振搖提取2次,每次30 mL,棄去三氯甲烷液,水溶液用水飽和的正丁醇振搖提取5次,每次20 mL,合并正丁醇液,用1%氫氧化鈉溶液洗滌2次,每次30 mL,再用正丁醇飽和的水30 mL洗滌,合并氫氧化鈉洗液和水洗液,用水飽和的正丁醇振搖提取3次,每次20 mL,合并正丁醇提取液,并與上述正丁醇液合并,蒸干,殘?jiān)?0%甲醇溶液溶解并轉(zhuǎn)移至10 mL容量瓶中,加入70%甲醇溶液至標(biāo)線,搖勻,濾過(guò),取續(xù)濾液,得樣品溶液。
按照七味糖脈舒膠囊處方中藥材配比及制法,制備不含紅參藥材的陰性樣品,同法制備不含紅參的陰性樣品溶液。
1.5 實(shí)驗(yàn)方法
取人參皂苷Rb1系列標(biāo)準(zhǔn)工作溶液、七味糖脈舒膠囊樣品溶液和陰性樣品溶液,按1.2色譜條件進(jìn)行測(cè)定,記錄色譜圖,以色譜峰面積外標(biāo)法計(jì)算樣品中人參皂苷Rb1含量。
2 結(jié)果與討論
2.1 色譜條件優(yōu)化
2.1.1 色譜柱和梯度洗脫條件選擇
嘗試采用乙腈-水(體積比為30∶70)為流動(dòng)相等度洗脫,但分離度達(dá)不到要求且陰性樣品有干擾,故考慮梯度洗脫。以水為流動(dòng)相A,乙腈為流動(dòng)相B,設(shè)置梯度洗脫程序:0~20 min時(shí)B相體積分?jǐn)?shù)為20%,20~45 min時(shí)B相體積分?jǐn)?shù)為20%~46%,采用Waters Symmetry shield RP18色譜柱(250 mm×4.6 mm,5 μm)進(jìn)行樣品分析時(shí),人參皂苷Rb1與其前的雜質(zhì)峰分不開(kāi);采用月旭Ultimate PG-C18色譜柱(250 mm×4.6 mm,5 μm)時(shí),人參皂苷Rb1與其前后雜質(zhì)峰的分離度均小于1.2,分離度較差。為提高分離效果,考慮選擇小粒徑短柱。選擇Agilent InfinityLab Poroshell 120 EC-C18色譜柱(100 mm×4.6 mm,2.7 μm),并進(jìn)行梯度洗脫程序優(yōu)化,首先設(shè)置梯度洗脫程序:0~20 min時(shí)B相體積分?jǐn)?shù)為19%,20~30 min時(shí)B相體積分?jǐn)?shù)為19%~30%,30~45 min時(shí)B相體積分?jǐn)?shù)為30%~35%,該條件下人參皂苷Rb1與其后的雜質(zhì)峰不能達(dá)到基線分離。調(diào)整梯度:0~12 min時(shí)B相體積分?jǐn)?shù)為19%,12~30 min時(shí)B相體積分?jǐn)?shù)為19%~29%,30~45 min時(shí)B相體積分?jǐn)?shù)為29%~35%,該條件下分離度良好,陰性樣品無(wú)干擾,最終優(yōu)化結(jié)果見(jiàn)表1。
2.1.2 柱溫的選擇
考察色譜柱溫度分別為25、30、35 ℃時(shí)人參皂苷Rb1的分離效果。結(jié)果表明,上述柱溫下,人參皂苷Rb1質(zhì)量分?jǐn)?shù)測(cè)定結(jié)果無(wú)明顯差異,分離效果良好。為滿足耐用性要求,故選擇柱溫為30 ℃。
2.2 樣品處理?xiàng)l件優(yōu)化
2.2.1 提取方式和提取時(shí)間選擇
在制備七味糖脈舒膠囊樣品溶液時(shí),分別考察了超聲和回流兩種提取方式,結(jié)果表明,回流提取時(shí)人參皂苷Rb1質(zhì)量分?jǐn)?shù)測(cè)定結(jié)果為0.385 5 mg/g,超聲提取的測(cè)定結(jié)果為0.201 5 mg/g,回流提取效果更好,故選擇回流提取方式。
選擇提取時(shí)間分別為0.5、1、1.5、2 h對(duì)七味糖脈舒膠囊樣品進(jìn)行提取,并測(cè)定人參皂苷Rb1的質(zhì)量分?jǐn)?shù),結(jié)果見(jiàn)表2。由表2可知,隨著提取時(shí)間的延長(zhǎng),人參皂苷Rb1的質(zhì)量分?jǐn)?shù)增加不明顯,故選擇提取時(shí)間為1 h。
表2 不同提取時(shí)間時(shí)人參皂苷Rb1的質(zhì)量分?jǐn)?shù)
Tab. 2 Mass fraction of ginsenoside Rb1 at different extraction times

2.2.2 正丁醇提取次數(shù)選擇
采用水飽和的正丁醇分別提取4、5、6次,并測(cè)定七味糖脈舒膠囊中人參皂苷Rb1的質(zhì)量分?jǐn)?shù),結(jié)果見(jiàn)表3。由表3可知,用水飽和的正丁醇提取5次時(shí),人參皂苷Rb1的質(zhì)量分?jǐn)?shù)較大,增加提取次數(shù),質(zhì)量分?jǐn)?shù)增加不明顯,故選擇用水飽和的正丁醇提取5次。
表3 不同提取次數(shù)時(shí)人參皂苷Rb1的質(zhì)量分?jǐn)?shù)
Tab. 3 Mass fraction of ginsenoside Rb1 at different extraction times

2.2.3 氫氧化鈉溶液洗滌次數(shù)選擇
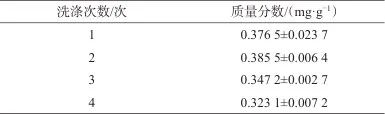
采用1%氫氧化鈉溶液分別洗滌1、2、3、4次,并測(cè)定七味糖脈舒膠囊中人參皂苷Rb1的質(zhì)量分?jǐn)?shù),結(jié)果見(jiàn)表4。由表4可知,用1%氫氧化鈉溶液洗滌2次時(shí),人參皂苷Rb1的質(zhì)量分?jǐn)?shù)最高,然后隨著洗滌次數(shù)增加,質(zhì)量分?jǐn)?shù)逐漸降低,故選擇用1%氫氧化鈉溶液洗滌2次。
表4 不同洗滌次數(shù)時(shí)人參皂苷Rb1的質(zhì)量分?jǐn)?shù)
Tab. 4 Mass fraction of ginsenoside Rb1 at different washing times
2.3 專屬性試驗(yàn)
取空白溶液、人參皂苷Rb1對(duì)照品溶液、七味糖脈舒膠囊樣品溶液和陰性樣品溶液,按1.2色譜條件進(jìn)行測(cè)定,色譜圖如圖1所示。由圖1可以看出,該色譜條件下,人參皂苷Rb1對(duì)照品溶液、七味糖脈舒膠囊樣品溶液在相同保留時(shí)間處具有同一色譜峰,人參皂苷Rb1分離度良好,空白溶液和陰性樣品溶液無(wú)干擾,表明該方法專屬性良好。

圖1 對(duì)照品溶液、空白溶液、陰性樣品溶液與樣品溶液色譜圖
Fig. 1 Chromatograms of reference solution,blank solvent,negative sample solution and sample solution
2.4 線性方程與檢出限
在1.2色譜條件下,測(cè)定人參皂苷Rb1系列標(biāo)準(zhǔn)工作溶液,以人參皂苷Rb1的質(zhì)量濃度為橫坐標(biāo),以色譜峰面積為縱坐標(biāo)進(jìn)行線性回歸,得線性方程為y=2.824 8x+2.041 4,相關(guān)系數(shù)為0.999 9,表明人參皂苷Rb1的質(zhì)量濃度在15.05~300.99 μg/mL范圍內(nèi)與色譜峰面積線性關(guān)系良好。
取人參皂苷Rb1對(duì)照品貯備液,用70%甲醇溶液逐級(jí)稀釋,按1.2色譜條件測(cè)定,分別以3倍信噪比和10倍信噪比對(duì)應(yīng)的質(zhì)量濃度作為方法檢出限和定量限,根據(jù)稱樣質(zhì)量和定容體積,換算成樣品中的含量,以質(zhì)量分?jǐn)?shù)(mg/g)表示,得檢出限為0.000 430 mg/g,定量限為0.001 08 mg/g。
2.5 溶液穩(wěn)定性試驗(yàn)
取人參皂苷Rb1對(duì)照品溶液和七味糖脈舒膠囊樣品溶液,分別于室溫放置的第0、8、12、16、20、24、28、32、36、40、44、48 h,按1.2色譜條件進(jìn)樣測(cè)定,色譜峰面積測(cè)定結(jié)果見(jiàn)表5。由表5可知,各時(shí)間點(diǎn)對(duì)照品溶液和樣品溶液中人參皂苷Rb1色譜峰面積測(cè)定值的相對(duì)標(biāo)準(zhǔn)偏差分別為0.29%和0.35%,表明對(duì)照品溶液和樣品溶液于室溫放置48 h內(nèi)穩(wěn)定。
表5 穩(wěn)定性試驗(yàn)結(jié)果
Tab. 5 Results of stability test

2.6 精密度試驗(yàn)
取七味糖脈舒膠囊樣品,按1.4方法平行制備6份樣品溶液,按1.2色譜條件進(jìn)行檢測(cè),記錄色譜圖,計(jì)算6份樣品中人參皂苷Rb1的質(zhì)量分?jǐn)?shù),試驗(yàn)結(jié)果列于表6。由表6可知,人參皂苷Rb1質(zhì)量分?jǐn)?shù)的RSD為1.90%,表明該方法精密度良好。
表6 精密度試驗(yàn)結(jié)果
Tab. 6 Results of precision test

2.7 樣品加標(biāo)回收試驗(yàn)
取已知人參皂苷Rb1含量的七味糖脈舒膠囊樣品9份,平均每份約3.5 g,精密稱定,分成3組,按照低、中、高3個(gè)水平進(jìn)行加標(biāo)回收試驗(yàn),分別精密加入人參皂苷Rb1對(duì)照品貯備液適量,按1.4樣品處理方法制備加標(biāo)樣品溶液,在1.2色譜條件下進(jìn)行檢測(cè),計(jì)算平均回收率,結(jié)果列于表7。由表7可知,樣品加標(biāo)平均回收率為98.97%,表明該方法準(zhǔn)確度良好。
表7 樣品加標(biāo)回收試驗(yàn)結(jié)果
Tab. 7 Results of samples spiked recovery test

3 結(jié)論
(1) 建立了高效液相色譜法測(cè)定七味糖脈舒膠囊中人參皂苷Rb1的含量。對(duì)提取方式(超聲、回流)、提取時(shí)間、提取次數(shù)、堿洗次數(shù)進(jìn)行優(yōu)化,確定了最佳樣品處理方法;采用小粒徑短柱,在提高分離度的同時(shí),縮短了分析時(shí)間,降低了檢測(cè)成本,提高了檢驗(yàn)效率。
(2) 在色譜柱選擇和梯度優(yōu)化過(guò)程中同時(shí)考察了人參皂苷Rg1和人參皂苷Re的分離情況,但由于二者在七味糖脈舒膠囊中的含量不高,考慮到檢測(cè)成本,最終只檢測(cè)了人參皂苷Rb1,后期將根據(jù)品種需要補(bǔ)充相關(guān)試驗(yàn)同時(shí)進(jìn)行人參皂苷Rg1和人參皂苷Re控制。
(3) 該方法操作簡(jiǎn)單、精密度好、準(zhǔn)確度和靈敏度高,具有良好的線性關(guān)系,可用于七味糖脈舒膠囊的質(zhì)量控制。
參考文獻(xiàn)
1 曲頌楊,關(guān)開(kāi),胡航,等.七味糖脈舒片HPLC指紋圖譜建立及其中6種成分同時(shí)測(cè)定[J].國(guó)際藥學(xué)研究雜志,2020,47(6): 477.
QU Songyang,GUAN Kai,HU Hang,et al. Establishment of HPLC fingerprints of Qiwei Tangmaishu tablet and simultaneous determination of six constituents[J].Journal of International Pharmaceutical Research,2020,47(6): 477.
2 樊偉旭,詹志來(lái),侯芳潔,等.紅參的化學(xué)成分及藥理作用研究進(jìn)展[J].天然產(chǎn)物研究與開(kāi)發(fā),2021,33: 137.
FAN Weixu,ZHAN Zhilai,HOU Fangjie,et al. Research progress on chemical constituents and pharmacological activities of Ginseng Radix et Rhizoma Rubra[J]. Natural Product Research Develepment,2021,33: 137.
3 齊夢(mèng)含,鄭毅男,李偉.紅參中氨基酸糖苷類化學(xué)成分研究進(jìn)展[J].中草藥,2024,55(19): 6 779.
QI Menghan,ZHENG Yinan,LI Wei. Research progress on chemical constituents of amino acid glycosides of Ginseng Radix et Rhizoma Rubra[J]. Chinese Traditional and Herbal Drugs,2024,55(19): 6 779.
4 湯淼淼,趙姝婷,李冉琪,等.紅參的炮制方法、化學(xué)成分及藥理研究進(jìn)展[J/OL].特產(chǎn)研究.[2024-12-05]. https://doi.org/10.16720/j.cnki.tcyj.2024.037.
TANG Miaomiao,ZHAO Shuting,LI Ranqi,et al. Research prosress on processing methods,chemical compesition and pharmacology of Red Ginseng[J/OL]. Special Wild Economic Animal and Plant Research.[2024-12-05]. https://doi.org/10.16720/j.cnki.tcyj.2024.037.
5 毛蕊,丁傳波,張帥,等.紅參的生物活性及綜合利用研究概況[J].上海中醫(yī)藥雜志,2024,58(2): 11.
MAO Rui,DING Chuanbo,ZHANG Shuai,et al. Overview of biological activities and comprehensive utilization of Ginseng Radix et Rhizoma Rubra[J].Shanghai Journal of Traditional Chinese Medicine,2024,58(2): 11.
6 周秋秋,任謂明,王艷紅,等.紅參的炮制、化學(xué)成分及藥理活性研究進(jìn)展[J].上海中醫(yī)藥雜志,2016,50(2): 97.
ZHOU Qiuqiu,REN Weiming,WANG Yanhong,et al. Research progress on processing drugs methods,chemical composition and pharmacological activity of red ginseng[J]. Shanghai Journal of Traditional Chinese Medicine,2016,50(2): 97.
7 李立定,周華麗,王鵬,等.紅參粉末治療糖尿病視網(wǎng)膜病變的臨床觀察[J].現(xiàn)代生物醫(yī)學(xué)進(jìn)展,2013,13(29): 5 772.
LI Liding,ZHOU Huali,WANG Peng,et al. Observation about the clinical effects of Red Ginseng powder on the treatment of diabetics Retinopathy[J]. Progress in Modern Biomedicine,2013,13(29): 5 772
8 鄧輝,金明,潘琳,等.紅參對(duì)糖尿病大鼠視網(wǎng)膜血管內(nèi)皮細(xì)胞生長(zhǎng)因子表達(dá)及神經(jīng)節(jié)細(xì)胞凋亡的影響[J].中日友好醫(yī)院學(xué)報(bào),2010,24(2): 94.
DENG Hui,JIN Ming,PAN Lin,et al. Ginseng on vascular endothelial growth factor expression and retina ganglion cells apoptosis in diabetic rats[J]. Journal of China-Japan Friendship Hospital,2010,24(2): 94.
9 張瀚文,石巖.黃芪-紅參治療糖尿病視網(wǎng)膜病變的潛在靶點(diǎn)及網(wǎng)絡(luò)藥理學(xué)作用機(jī)制研究[J].中華中醫(yī)藥學(xué)刊,2021,39(5): 101.
ZHANG Hanwen,SHI Yan. Study on potential targets and network pharmacological mechanisms of Huangqi(Astragali Radix)-Hongshen(Ginseng Radix Et Rhizoma Rubra) for diabetic retinopathy[J]. Chinese Archives of Traditional Chinese Medicine,2021,39(5): 101.
10 鄧輝,金明,潘琳,等.紅參對(duì)糖尿病視網(wǎng)膜神經(jīng)節(jié)細(xì)胞的神經(jīng)保護(hù)作用[J].中國(guó)中醫(yī)眼科雜志,2004,14(2): 5.
DENG Hui,JIN Ming,PAN Lin,et al. An experimental research on protective effect of ginseng in retinal ganglion cells with diabetes mellitus[J]. China Journal of Chinese Ophthalmology,2004,14(2): 5.
11 辛旭陽(yáng),鄒桂欣,趙玥,等.化胃舒顆粒中紅參的皂苷類成分含量測(cè)定方法及其降解產(chǎn)物研究[J].中南藥學(xué),2022,20(2): 415.
XIN Xuyang,ZOU Guixin,ZHAO Yue,et al. Content determination of ginsenosides and degradation products of red ginseng in Huaweishu granules[J].Central South Pharmacy,2022,20(2): 415.
12 畢福鈞,鐘順好,顧利紅. RRLC法與HPLC法在紅參和西洋參人參皂苷含量測(cè)定中的分析比較[J].藥物分析雜志,2010,30(9): 1 720.
BI Fujun,ZHONG Shunhao,GU Lihong. Comparison between RRLC and HPLC for determination of ginsenoside Rg1,Re and Rb1 in radix et Rhizom a Ginseng Rubra and Radix Panacis Quinuefolii[J]. Chinese Journal of Pharmaceutical Analysis,2010,30(9): 1 720.
13 劉慧,唐心恬,婁慧慧,等.高效液相色譜法同時(shí)測(cè)定還腦益聰方中7種人參成分含量[J].時(shí)珍國(guó)醫(yī)國(guó)藥,2022,33(12): 2 933.
LIU Hui,TANG Xintian,LOU Huihui,et al. Determination content of 7 components in Huan-Nao-Yi-Cong-Fang by HPLC[J]. Lishizhen Medicine and Materia Medica Research,2022,33(12): 2 933.
14 劉艷玲,于艷,田原,等.高效液相色譜法測(cè)定溫陽(yáng)活血軟膠囊中7種成分的含量[J].遼寧中醫(yī)雜志,2021,48(5): 133.
LIU Yanling,YU Yan,TIAN Yuan,et al. Determination of seven constituents in Wenyang Huoxue Soft Capsule by HPLC[J].Liaoning Journal of Traditional Chinese Medicine,2021,48(5): 133.
15 劉巧明,奉建芳,梁健欽,等.復(fù)方扶芳藤合劑和復(fù)方扶芳藤膠囊劑生產(chǎn)后藥渣中有效成分的含量測(cè)定[J].廣東藥科大學(xué)學(xué)報(bào),2021,37(1): 34.
LIU Qiaoming,F(xiàn)ENG Jianfang,LIANG Jianqin,et al. Determination of active ingredient in herbal residue from Fufang Fufangteng mixture and Fufang Fufangteng capsule[J]. Journal of Guangdong Pharmaceutical University,2021,37(1): 34.
16 劉光斌,王艷,張玉葉,等.紅參川貝咳喘丸的質(zhì)量控制方法研究[J].中獸醫(yī)醫(yī)藥雜志,2019,38(5): 50.
LIU Guangbin,WANG Yan,ZHANG Yuye. Study on quality control method for Hongshen Chuanbei Kechuan pills[J]. Journal of Traditional Chinese Veterinary Medicine,2019,38(5): 50.
17 張?jiān)氯纾w景瑩,湯慧麗,等.高效液相色譜法測(cè)定人參屬植物提取物中9種人參皂苷[J].化學(xué)分析計(jì)量,2024,33(11): 26.
ZHANG Yueru,ZHAO Jingying,TANG Huili,et al. Determination of 9 ginsenosides in extracts of panax species by high performance liquid chromatography[J]. Chemical Analysis and Meterage,2024,33(11): 26.

來(lái)源:化學(xué)分析計(jì)量


