您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2024-07-17 14:04
本文適用于《醫療器械分類目錄》中管理類別為Ⅱ類的呼吸管路,分類編碼為08-06-02。
一、麻醉機和呼吸機用呼吸管路產品的結構組成和工作原理
1.結構組成
產品通常為“人”字形或“一”字形結構的波紋管,部分管路可以做軸向伸縮,人字形結構的管路由吸氣支路和呼氣支路組成,一般由塑料或硅橡膠材料制成的。根據YY/T 0461《麻醉機和呼吸機用呼吸管路》中所敘述的結構可以分為單管路型(見圖1)、雙管路型(見圖2)。根據臨床需要呼吸管路結構會有所不同,例如常見的還有雙管路加強筋型(見圖3)、雙管路可伸縮型(見圖4)、雙管路加強筋積水杯型(見圖5)、雙管路可伸縮積水杯型(見圖6)等。
結構示意圖如下:

轉換接頭;2-管路;3-機器端接頭
圖1單管路型
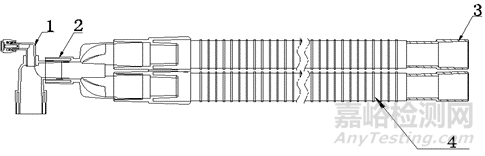
1-轉換接頭;2-Y形件;3-機器端接頭;4-管路
圖2 雙管路型

1-轉換接頭;2-Y形件;3-機器端接頭;4-加強筋管路
圖3 雙管路加強筋型

1-轉換接頭;2-Y形件;3-機器端接頭;4-可伸縮管路
圖4 雙管路可伸縮型

1-轉換接頭;2-Y形件;3-積水杯;4-機器端接頭;5-加強筋管路
圖5 雙管路加強筋積水杯型

1-轉換接頭;2-Y形件;3-積水杯;4-機器端接頭;5-可伸縮管路
圖6 雙管路可伸縮積水杯型
以上所示均為常見呼吸管路的結構示意圖,還可能有其他不同結構形式的呼吸管路。
2、工作原理
單管路型
單管路是為麻醉機或呼吸機與面罩之間建立一個單向氣體通道。用于將麻醉機或呼吸機輸出的氣體通過呼吸閥輸送到面罩中,供病人吸入,病人呼出的氣體經面罩排出體外。
雙管路型
雙管路是用于麻醉機或呼吸機與病人之間建立一個呼吸連接通道。其中一根管路是將麻醉機或呼吸機輸出的氣體輸送給病人,另一根管路是將病人呼出的氣體通過麻醉機或呼吸機排出體外。
含有積水杯的管路,積水杯是用于處理管路內的結露,并保持管路正常通氣,降低液體再通過管路進入呼吸機內部或病人呼吸道的風險。
二、麻醉機和呼吸機用呼吸管路產品的主要風險
麻醉機和呼吸機用呼吸管路產品主要危險見表
表產品主要危險(源)(舉例)
|
危險(源)的分類 |
危險(源)的形成因素 |
可能的后果 |
|
|---|---|---|---|
|
生物學危險(源) |
生物污染 |
1.環境控制不好 2.操作不嚴格 3.破損 4.使用時操作不規范 |
產品帶菌,引起患者氣道或肺部感染 |
|
生物不相容性 |
硅橡膠硫化劑分解不完全 |
產生毒性或刺激對人體造成致癌作用,特別是造成內分泌的紊亂 |
|
|
不正確的配方(化學成分) |
1.未按照工藝要求配料 2.材料選用不當 |
1.可能引起管內壁微粒物質殘留量過大,造成毒性危害 2.成分與所接觸物質的不相容性(抗變形、低吸附、低透過) 3、對內涂層的管路可能產生微粒污染 |
|
|
再感染和/或交叉感染 |
1.使用不當 2.標識不清 |
引起交叉感染 |
|
|
環境危險(源) |
貯存或運行偏離規定的環境條件 |
貯運條件(如溫度、濕度)不符合要求 |
產品非正常老化 無菌有效期縮短 |
|
意外的機械破壞 |
貯運、使用過程中發生意外的機械性破壞 |
產品使用性能無法得到保證 |
|
|
環境危險(源) |
由于廢物和(或)醫療器械處置的污染 |
使用后的產品沒有按照要求集中銷毀 |
造成環境污染 |
|
與醫療器械使用有關的危險(源) |
不適當的標志 |
1.標志不清晰、錯誤 2.沒有按照要求進行標志 |
錯誤使用 貯存錯誤 產品辨別錯誤 |
|
不適當的操作說明,如: (1)和醫療器械一起使用的附件不適當 (2)預先檢查不適當 (3)操作說明書敘述不適當 |
操作失誤,檢查不嚴謹,醫療器械自身存在的問題
|
無法保證使用安全性 |
|
|
1.由不熟練/未經培訓的人員使用 2.呼吸管路臨床使用易出現的問題 |
1.呼吸管路操作不規范、不熟練、操作失誤 2.呼吸管路與機器連接不牢,或選擇長度不適當的呼吸管路 3.小孔接頭誤接風險 |
1.操作不規范可能導致麻醉或供氧失敗,再者造成管體出現死折等問題 2.呼吸管路脫落或打折造成通氣困難,導致使用目的失敗 3.導致不是預期連接 |
|
|
產品材料和工藝 |
配方不符合要求、未按工藝操作 |
呼吸管路破裂、打折,薄厚不均勻 |
|
|
不合理的誤用 |
規格型號選用錯誤 |
導致無法達到滿意的通氣效果 |
|
|
與醫療器械使用有關的危險(源) |
1.對一次性使用醫療器械很可能再次使用的危害警告不適當 2.對重復性使用的危害 |
1.造成重復使用 2.使用前未按規定清洗、消毒或滅菌
|
造成交叉感染 |
|
功能性失效、維修和老化引起的危險(源) |
對醫療器械壽命終止缺少適當的規定 |
沒有產品標識或標示不清 |
超出有效期的產品被使用,造成細菌感染或因材料老化而導致產品性能不符合要求 |
|
不適當的包裝 |
沒有進行包裝確認 |
造成產品污染,從而導致出現細菌感染 |
|
|
重復使用的醫療器械 |
超出使用壽命,產品老化 |
功能障礙或喪失 |
|
1、產品性能研究
開發人應根據產品的技術特征和臨床使用情況來確定產品安全有效、質量可控的性能指標和檢驗方法。麻醉機和呼吸機用呼吸管路的性能指標及試驗方法應參考引用YY/T 0461《麻醉機和呼吸機用呼吸管路》。若未采用YY/T 0461中給出的試驗方法,應明確所使用的試驗方法的來源依據并開展方法學驗證。
2、生物相容性的評價研究
生物相容性評價研究應當明確生物相容性評價的依據和方法,產品所用材料及與人體接觸的性質,實施或豁免生物學試驗的理由,對于現有數據或試驗結果的評價。
產品首次注冊時應根據產品所用材料及與人體的接觸性質、接觸時間,按照GB/T16886.1《醫療器械生物學評價第1部分:風險管理過程中的評價與試驗》、YY/T 1778.1《醫療應用中呼吸氣體通路生物相容性評價第1部分:風險管理過程中的評價與試驗》要求對其進行生物相容性評價。若產品接觸時間少于等于24小時,考慮的生物相容性評價終點需至少包括:細胞毒性、致敏、刺激(粘膜刺激)或皮內反應。若產品接觸時間大于24小時,考慮的生物相容性評價終點需至少包括:細胞毒性、致敏、刺激(粘膜刺激)或皮內反應、急性全身毒性、亞急性毒性、植入反應。
3、滅菌工藝研究
麻醉機和呼吸機用呼吸管路以無菌形式供應,明確用于保證產品無菌的質量保證體系,明確滅菌工藝(方法和參數)和無菌保證水平(SAL)。麻醉機和呼吸機用呼吸管路的無菌保證水平(SAL)需達到10-6,開展滅菌確認,內容應符合GB18279《醫療保健產品滅菌環氧乙烷》系列標準、GB18280《醫療保健產品滅菌輻射》系列標準等的規定。滅菌確認應考慮產品與滅菌過程的適應性、包裝和標簽與滅菌過程的適應性等內容。
殘留毒性:若滅菌使用的方法容易出現殘留,如環氧乙烷滅菌,應當參考GB/T 16886.7《醫療器械生物學評價第7部分:環氧乙烷滅菌殘留量》等標準明確殘留物信息(如EO、ECH)及采取的處理方法和條件,并開展研究。
4、加工助劑的研究
明確生產過程中各種加工助劑的使用情況及對雜質(如殘留單體、小分子殘留物等)的控制情況,如粘結用環己酮的配方及限量,應對環己酮的配方和限量的安全性進行分析評價。
5、產品穩定性研究
產品有效期的驗證可采用實時老化或加速老化的研究。如果選擇加速老化研究,應評估產品是否適用于加速老化,若適用,可采用加速老化研究作為貨架有效期的支持性研究。在穩定性研究中應監測整個有效期內確保產品安全性和有效性的關鍵參數。加速老化研究試驗的具體要求可參照YY/T0681系列標準。
產品有效期驗證試驗宜采用與常規生產相同的終產品進行。驗證項目需評估產品隨時間老化的相關性能,包括產品自身性能驗證和包裝系統性能驗證兩方面。前者需選擇與醫療器械有效期密切相關的物理、化學、微生物測試項目,涉及產品生物相容性可能發生改變的,需進行生物學評價。后者包括包裝完整性、包裝強度和微生物屏障性能等驗證項目。其中,包裝完整性驗證項目可包括在設定的時間間隔點目力檢測產品包裝(是否污染、破損等)及標簽(完整性、粘附牢固度、印刷內容清晰度等)、采用染色液穿透法測定透氣包裝的密封泄漏試驗和氣泡法測定軟性包裝泄漏試驗等;包裝強度測試項目包括軟性屏障材料密封強度試驗、無約束包裝抗內壓破壞試驗等。
需要開展運輸穩定性研究,證明在規定的運輸條件下,運輸過程中的環境條件不會對醫療器械的造成不利影響。根據適用情況可選擇人工搬運、堆碼、振動、低氣壓、集中沖擊等模擬運輸試驗驗證包裝系統性能。
申報產品如為重復使用,應明確重復使用的最大次數及清洗、消毒或滅菌方法,相應的儲存方式和最長儲存時間,并開展按照該程序處理后仍能滿足相關性能要求的驗證。
6、其他
對于列入《免于臨床評價醫療器械目錄》的麻醉機和呼吸機用呼吸管路可免于進行臨床評價。開發人應當按照《列入免于臨床評價醫療器械目錄產品對比說明技術指導原則》的要求,從基本原理、結構組成、性能、安全性、適用范圍等方面,證明產品的安全有效性。

來源:嘉峪檢測網


