今日頭條
艾欣達偉小分子偶聯新藥獲批臨床。深圳艾欣達偉醫藥基于“乏氧活化”前藥的技術平臺自主開發的小分子偶聯新藥AST-006獲國家藥監局臨床許可,擬開發用于BRCA1/2突變惡性腫瘤的治療。AST-006能夠在缺氧區域被激活,產生活性代謝產物Br-IPM,導致腫瘤細胞死亡。在多項臨床前研究中,AST-006具有良好的安全性以及廣譜的抗腫瘤活性,預期為BRCA1/2突變惡性腫瘤,特別是對PARP抑制劑耐藥的腫瘤患者提供新的治療選擇。
國內藥訊
1.譽衡PD-1單抗獲批宮頸癌適應癥。譽衡生物PD-1抑制劑賽帕利單抗(GLS-010,商品名為譽妥)獲國家藥監局批準新適應癥,用于接受過一線或以上含鉑標準化療后進展的復發或轉移、PD-L1表達陽性(CPS≥1)的宮頸癌。GLS-010通過阻斷PD-1信號通路來激發人體自身的免疫系統,清除患者體內的癌細胞,從而實現抗腫瘤作用。2021年8月,該產品在中國獲批首個適應癥,用于治療二線以上復發或難治性經典型霍奇金淋巴瘤。
2.上海丹瑞細胞免疫療法上Ⅲ期臨床。上海丹瑞生物細胞免疫療法Sipuleucel-T注射液(Provenge)在治療轉移性去勢抵抗性前列腺癌(mCRPC)的中國III期臨床完成首例患者回輸。Provenge是全球首款實體瘤領域的細胞免疫療法,主要成分是經過PA2024抗原體外激活的來源于患者自體的免疫細胞,已于2010年獲FDA批準上市,用于治療mCRPC。Real-world研究數據顯示,在Zytiga®或Xtandi®中添加Provenge,mCRPC患者的死亡風險將降低45%,總生存期延長14.5個月。
3.康方IL-12/23單抗UC早期臨床積極。康方生物在FOCIS 2023年會上公布其IL-12/23p40單克隆抗體依若奇單抗(AK101)治療中重度活動性潰瘍性結腸炎(UC)的Ⅰ期臨床積極結果。8周治療數據顯示,AK101可提高改良Mayo評分(患者活動期嚴重程度的評判標準)和Mayo評分的臨床應答率,以及改善患者的排便次數和便血癥狀。治療期間不良事件(TEAE)多為輕中度。此前,該產品治療中重度銀屑病的Ⅲ期臨床已達到主要研究終點。
4.創勝Claudin18.2抗體胃癌早期臨床積極。創勝集團在ESMO2023年會上公布Claudin18.2單抗Osemitamab (TST001) 聯合卡培他濱和奧沙利鉑(CAPOX)一線治療CLDN18.2表達水平的晚期胃/胃食管連接部(G/GEJ)癌的I/II期臨床(NCT04495296)擴展研究C隊列積極結果。中位隨訪為195天時,Osemitamab(6mg/kg)治療達到66.7%的部分緩解。預計中位無進展生存期(PFS)為9.5個月。無進展生存期與CLDN18.2表達水平無明顯相關性。Osemitamab的安全性主要表現為可控的非特異性靶向副作用。
5.瓔黎泛KRAS突變抑制劑獲批臨床。瓔黎藥業自主研發的泛KRAS突變小分子抑制劑YL-17231獲FDA批準在美國開展I期臨床研究。在臨床前研究中,與現有KRAS抑制劑相比,YL-17231對于更多的KRAS突變類型具有更強的抑制作用,廣泛適用于攜帶KRAS G12C、G12D、G12V、G13D、G12R、G12A等突變,以及KRAS野生型擴增的癌癥和對KRAS G12C抑制劑(如sotorasib和adagrasib)產生耐藥性的癌癥。此前,國內外尚未有這類抑制劑藥物進入臨床。
6.湖南九天眼內注射基因療法美國獲批臨床。九天生物AAV眼科基因治療藥物SKG0106獲FDA批準,即將開展全球I/IIa期臨床,評估用于新生血管性年齡相關性黃斑變性(nAMD)的安全性與有效性。SKG0106攜帶編碼獨特的抗VEGF蛋白的轉基因序列,通過單次玻璃體腔注射后在眼內高效轉導視網膜細胞表達抗VEGF蛋白,以抑制VEGF生物活性并阻斷眼內新生血管增生。去年年底,該新藥已在國內獲批臨床。
7.復諾健新一代溶瘤病毒獲批臨床。復諾健非減毒骨架的溶瘤病毒產品VG203獲FDA批準開展Ⅰ期臨床試驗,評估用于治療晚期實體瘤患者的安全性與有效性。VG203使用CXCR4作為腫瘤特異性啟動子,并在臨床前實驗中表現出生物標記物CXCR4與病毒復制的良好相關性。該項試驗將同時關注有望取得更好療效的CXCR4陽性腫瘤,分析CXCR4表達水平與療效的關系,積極探索后期開展基于生物標記物指導的臨床試驗(籃式設計)的可能性。
8.信達EGFR/B7-H3雙抗報IND。信達生物1類生物制品IBI334的臨床試驗申請獲CDE受理。IBI334是一款EGFR/B7H3雙抗,已于今年3月在Clinicaltrials.gov網站上登記注冊了一項Ⅰ期臨床試驗,計劃入組128例晚期實體瘤患者,評估IBI334用于治療晚期實體瘤的安全性、耐受性和藥代動力學特征,以及初步療效。該項試驗預計從今年7月份啟動,2025年10月初步完成。據悉,信達生物已有10款雙抗新藥進入臨床階段。
國際藥訊
1.阿斯利康TROP2 ADC肺癌III期臨床積極。阿斯利康與第一三共開發的TROP2-ADC藥物Dato-DXd(datopotamab deruxtecan)用于治療局部晚期或轉移性非小細胞肺癌(NSCLC)經治患者的III期TROPION-lung 01研究獲積極結果。數據顯示,該研究達到無進展生存期(PFS)主要終點,總生存期(OS)主要終點還未成熟,但在中期分析中已觀察到有利于Dato-DXd的趨勢;安全性數據與已知研究一致,沒有觀察到新的安全信號。
2.RASP調節劑止咳Ⅱ期臨床積極。Aldeyra公司新型口服活性醛類物質(RASP)調節劑ADX-629治療慢性咳嗽患者的Ⅱ期臨床結果積極。與安慰劑組相比,ADX-629治療組的清醒時咳嗽頻率顯著降低(P=0.01),24小時咳嗽頻率(P=0.001)、清醒咳嗽計數(P=0.001)和24小時咳嗽計數(P=0.001)均達到統計學上的顯著性。ADX-629耐受性良好,沒有發現安全性問題。
3.皮質類固醇創新制劑膝關節疼痛臨床積極。Eupraxia公司開發的無需冷藏、基于皮質類固醇的膝部注射制劑EP-104IAR在治療膝骨關節炎相關疼痛的Ⅱb期臨床達到主要終點。與安慰劑相比,EP-104IAR治療12周時患者WOMAC疼痛評分具有統計學意義(p=0.004)的改善;WOMAC功能評分(p=0.014)、OMERACT-OARSI嚴格應答者(p=0.011)和WOMAC疼痛的曲線下面積(p<0.001)等三個次要終點也顯著改善。EP-104IAR耐受性良好,不良事件與安慰劑類似。
4.長效胰淀素類似物早期數據積極。Zealand公司長效胰淀素類似物ZP8396在用于正常體重和超重受試者的多劑量遞增(MAD)試驗的第一部分獲初步療效結果。在接受6次0.6mg和1.2mg的ZP8396治療后,受試者平均體重較基線分別減少5.3%和5.1%,而安慰劑組這一數值僅下降0.4%。ZP8396耐受性良好,沒有患者發生嚴重不良反應。目前該公司正在探索ZP8396更高暴露量的療效。
5.琺博進CTGF抗體肺纖維化Ⅲ期臨床失敗。琺博進靶向CTGF的潛在“first-in-class”抗體Pamrevlumab在治療特發性肺纖維化(IPF)患者III期試驗(ZEPHYRUS-1)未能達到主要和次要終點。pamrevlumab治療組從基線至第48周用力肺活量(FVC)平均降幅(260ml)較安慰劑組(330ml)未達到統計學顯著性;疾病進展的次要終點也不具顯著性改善。基于此結果,該公司已終止另一項針對IPF的III期試驗ZEPHYRUS-2。
醫藥熱點
1.上海知名三甲醫院郊區開新院區。 6月25日,上海市胸科醫院“心胸疾病臨床醫學中心”項目開工。該中心位于上海浦東新區唐鎮,設置床位600張,總建筑面積近12萬平方米。胸科醫院浦東新院區不僅將進一步優化上海市以及浦東區域醫療資源布局,也將結合浦東區位優勢推進心胸疾病臨床醫學研究與臨床應用進程。
2.復星醫藥聯席首席執行官辭職。7月3日,復星醫藥發布公告宣布,董事會接到陳玉卿先生的書面辭職函。因工作安排調整,陳玉卿先生向復星醫藥董事會申請辭去聯席首席執行官職務。陳玉卿先生自2023年7月1日起不再擔任復星醫藥聯席首席執行官職務。公開資料顯示,陳玉卿先生于2010年1月加入復星醫藥集團,曾任上海復星醫藥(集團)股份有限公司總裁助理兼人力資源部總經理等職。
3.臺灣地區去年新生兒死亡率4.4‰。臺灣島內相關機構2日召開降低新生兒死亡率研討會。據統計,臺灣地區新生兒出生數自2015年后逐年下滑,新生兒死亡率近3年卻逐步攀升,去年新生兒死亡率是4.4‰(創15年新高),是日本的2.7倍、韓國的1.6倍,而去年嬰兒死亡率,即每千名活產嬰兒未滿1歲即死亡者,達到2.8‰。新生兒快速死亡與“源于周產期的呼吸性疾患”“與妊娠長短及胎兒生長有關的疾患”“先天性畸形或染色體異常”等三大主因有關。
評審動態
1. CDE新藥受理情況(07月04日)
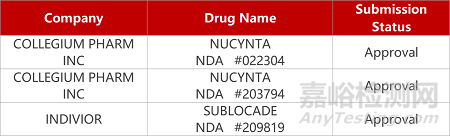
2. FDA新藥獲批情況(北美07月03日)