1995年,美國食品藥品監督管理局(FDA)提出了生物藥劑學分類系統(BCS)[1],即一種科學框架、將藥物基于其溶解性和滲透性分為 4 類��,目的是為藥品擴大生產規模�、上市后的變更(SUPAC)授予生物等效性(BE)豁免,并以溶出度試驗作為判定變更前后是否等效的依據,來替代昂貴耗時的體內研究[2-3]�。當時 BE 豁免僅用于藥品的變更申請���。隨后����,BE豁免的范圍被擴大至某些口服仿制藥的上市批準����。FDA于2000年頒布的《基于生物藥劑學分類的速釋口服固體制劑體內生物利用度和生物等效性豁免的指導原則》����,僅活性成分為高溶解性、高滲透性的藥物(BCS I類)且為口服速釋制劑的產品能被豁免�,在 2017年頒布的更新版本[4]中進一步將適用范圍擴展至活性成分為高溶解性��、低滲透性的藥物(BCS III類)。BE豁免的主要優勢在于可以簡化藥品的批準流程���、減少時間,從而降低了上市成本�。
經檢索中國國家藥品監督管理局(NMPA)及其他權威監管機構[如FDA����、歐盟藥品管理局(EMA)��、世界衛生組織(WHO)]出臺的有關人體 BE 豁免的指導原則��,可將 BE 豁免大致分為 2 種類型:第 1 種是基于仿制制劑某一規格產品的 BE試驗顯示與參比制劑生物等效去豁免其他規格的BE試驗;第2種是基于 BCS 分類豁免某種藥品(所含的原料藥為BCS I類�����、BCS III類)的BE試驗。
針對上述 2 種類型的豁免����,中國 NMPA 已出臺了《以藥動學參數為終點評價指標的化學藥物仿制藥人體BE研究技術指導原則》[5(] 第1種豁免)��、《人體生物等效性試驗豁免指導原則》[6(] 第2種豁免),FDA 頒布了《工業指南草案:按簡化新藥申請提交的以藥代動力學為終點的生物等效性研究》[7]�、《基于 BCS 分類系統的速釋口服固體劑型的體內生物利用度和生物等效性研究》[4]�,其中中國的指導原則主要參考FDA的制定�;而EMA、WHO則將第1種和第 2種類型整合在 1個指導原則中�����,即《生物等效性研究指南(2010 年版)》[8]����、《WHO 技術報告系列第37 號附件 7:仿制藥實現其可替代性的注冊要求指南》[9]�����。
為協調統一各成員國監管機構的技術要求�,國際人用藥品注冊技術協調委員會(ICH)于 2019 年針對第 2 種豁免頒布了《M9:基于生物制藥分類系統的生物豁免指導原則》[10]�,并在問答文件中闡述了該指南允許在仿制藥申請中存在地區性差異,以適應某些現有法規不允許仿制藥申請采用基于BCS豁免BE的例外情況。中國NMPA及美國FDA均陸續發布了實施該指導原則的通告���,以替代原有的指導原則。EMA 在官網發布了 ICH M9 并表明生效日期為2020年7月3日,但同時強調基于BCS I和 III 類豁免 BE 試驗并未在全球內達成共識,申報者需遵循不同地區的法規��。日本藥監局(PMDA)于2020 年 12 月在官網上公開了 M9 日文稿[11]并表明該指南可適用于部分申請(因參比制劑的處方難以獲得�,暫不適用于仿制藥)。綜上�����,ICH M9 基本替代了各國原有的第2種BE豁免指導原則���。而對于第 1 種豁免��,目前 ICH 正在起草并計劃于 2024 年完成《M13:速釋口服固體制劑的生物等效性》的制定�����,有望對各國現有的不同指導原則進行協調統一。
上述指導原則適用范圍存在差異之處�,但均包括了速釋口服固體制劑�����,WHO、PMDA 還明確了第1 種豁免亦適用于其他的特殊制劑(如遲釋、緩釋等)及非口服給藥途徑藥物��,FDA���、ICH M9提出第2種豁免還適用于新藥開發�����。因篇幅有限,本文分析的對象僅針對申報量大的速釋口服固體劑型仿制藥�����,旨在通過比較國內外相關指導原則對速釋口服固體劑型的仿制藥藥學研究的要求�����,重點關注存在的差異之處并在最終經 ICH 協調一致的過程中得到思考和啟示�,了解不同監管機構的申報要求�,以期使得研究者少走彎路,增加仿制藥被豁免體內試驗的成功率、進而降低開發成本���,但同時亦能保證其質量和療效與參比制劑一致,真正實現其臨床可替代性。
一、參比制劑的選擇
在仿制藥的注冊申報中,均須以參比制劑為標桿進行相關的研究���,因此需合理選擇參比制劑,而關于參比制劑研究批次的選擇��,不同監管機構的要求如下:
(1)日本《仿制藥BE研究的指導原則》[12]規定,取3批原研制劑進行溶出曲線研究,在其規定的溶出方法下測定,選取中間那條溶出曲線的批次作為參比制劑樣品,若 3 批原研制劑在 15 min 內溶出度均能達到 85%,則任一批次均可作為參比試劑,用于 BE批的參比制劑含量需與標示量接近且與仿制制劑含量的差值最好不超過 5%;
(2)中國要求多批[13(] 通常為 2 批及以上)進行藥學對比研究��,建議BE 批參比制劑含量與仿制制劑含量的差值小于5%[5]��;
(3)EMA 明確用于 BE 試驗參比制劑的選擇應基于含量(與仿制制劑的含量差值應不超過 5%)和溶出數據并要求申請人提供資料說明如何基于溶出和含量選擇代表性批次的參比制劑����,建議研究1 批 以 上 的 參 比 制 劑 以 確 定 BE 試 驗 用 的 批次[8]�;
(4)ICH M9征求意見稿中明確了至少 1批,而在正式稿中則刪除了關于參比制劑批次的描述[10]。
二����、對原料藥的具體要求
第2種BE豁免(基于BCS分類),對原料藥本身的理化性質(如結構���、溶解性)進行了限定。
其中關于溶解度的測定各指導原則均明確應在pH值1.2~6.8范圍內的水溶性介質中進行�,EMA和 ICH 還分別說明若藥物的 pKa����、最低溶解度所對應的 pH 值在 1.2~6.8 范圍內���,則需評價相應 pH 值下的溶解度�����,而我國及FDA指導原則還明確需考察pH=pKa±1 處的溶解度�。對于測試藥物的用量����,我國、EMA�����、WHO及ICH指導原則均明確采用最高劑量進行試驗��,ICH M9 還提出若單次治療的最高劑量不符合高溶解性標準���,但參比制劑的最高規格在要求條件下可溶解���,則應提供額外數據以證明基于BCS分類豁免BE的合理性�。
各指導原則中�����,ICH M9 最為詳細地闡述了溶解度的測定方法,強調了研究者容易忽略的試驗細節問題,如:
(1)溶解度試驗時間:應證明溶解度在預期吸收時間范圍內(在問答文件中說明了如何確定溶解度測定的持續時間)能維持穩定�。
(2)應在添加藥物活性成分后和平衡溶解度研究結束時測定每種試驗溶液的 pH 值�,以確保溶解度測定是在指定pH值下進行����,必要時應調節pH值。
(3)將以pH值1.2~6.8內測得的最低溶解度對藥物活性成分進行分類�����。
(4)應采用經適當驗證的方法測定溶解度��,使用藥典中適當的介質����,在每個溶解度條件或 pH 值下至少平行測定3個樣本�����。
(5)應證明藥物活性成分在溶解介質中具有足夠的穩定性�����,若藥物活性成分在溶解度測定過程中不穩定,即降解>10%�,則不能充分確定其溶解度�����,因此無法分類����。
在M9問答文件中明確應提供試驗獲得的溶解度數據以確定藥物活性成分的溶解性��。
三、對制劑處方工藝的要求
3.1 第1種豁免
基于某一規格生物等效豁免其他規格 BE 試驗���,其他規格的處方工藝則須滿足一定的前提條件,下文介紹不同監管機構的具體要求��。
3.1.1 NMPA[5]
若申請仿制制劑的其他規格 BE豁免���,則各規格制劑的處方比例相似���,是指以下情況:
(1)不同規格之間所有活性和非活性組分組成比例相似(2022年1月21日發布的問答文件[14]對此種情況進行了解釋說明)�����。
(2)對于高活性(highpotency)的藥物(活性成分在制劑中所占質量比例低):①不同規格的制劑質量一致(差異不超過10%)�;②各規格使用相同的非活性組分�;③規格的變更系通過改變活性組分的用量以及1個或多個非活性組分的用量來實現。
3.1.2 FDA[7]
處方相似性判斷有 3種情況:(1)不同規格之間所有活性和非活性組分組成比例相似,如50 mg規格所有非活性成分為100 mg規格的1/2,或為 25 mg 規格的 2 倍;
(2)符合以下條件:①不同規格的制劑質量幾乎相同(與 BE 規格的差異不超過10%)�����;②各規格使用相同的非活性組分���;③規格的變更系通過改變活性組分的用量以及1個或多個非活性組分的用量來實現��。
(3)不同規格間活性和非活性成分比例不相似但有充足的證據可證明處方相似的(FDA將在ANDA評估期間對處方相似性進行認定)����。
3.1.3 EMA[8]
(1)相同的制備工藝�����;(2)不同規格處方定性組成相同;(3)不同規格處方組成比例相似,如所有規格的原輔料比例相同(對于速釋制劑�����,包衣成分���、膠囊殼�、色素和香精除外)。當處方等比存在一定誤差時,若滿足以下①和②或①和③時則仍可判定處方相似,即可考慮豁免 BE:①活性成分占片芯或膠囊內容物質量的比不超過 5%��;②片芯或膠囊內容物中輔料的量與 BE 規格相同����,僅活性成分的量發生變化;③填充劑的改變量=活性成分的改變量��,其他輔料的量與BE規格相同���。
3.1.4 WHO[9]
不同規格制備工藝相同且處方相似�,以下 2 種形式均可被認為處方相似:
(1)不同規格之間所有活性和非活性組分組成比例相似(如 50 mg規格片劑中含有的活性和非活性組分均為 100 mg規格片劑的 1/2 或者為 25 mg 規格片劑的 2 倍),對于速釋制劑��,包衣成分�����、膠囊殼�、色素及香精通常無上述要求����;
(2)對于制劑中原料含量相對較低的情況(單位劑量最多含 10 mg,或質量百分比不超過5%),所用規格間的單位質量相似�����,若滿足以下條件則可考慮豁免:①片芯或膠囊內容物中輔料的量與BE規格相同�����,僅活性成分的量發生變化����;②填充劑的改變量=活性成分的改變量�,其他輔料的量與BE規格相同。
由上可知���,除 FDA 外,各監管機構對于處方相似性的判斷均分為兩種情況�����。第 1 種情況�,即不同規格間原料藥和輔料用量均呈等比增加或減少;而第 2 種情況���,各指導原則主要對原料藥百分比含量的要求略不同,EMA 明確為占比不超過 5%�����,WHO在 EMA 的基礎上增加了另一種情況(即單位劑量含有的活性成分至多10 mg)�,中國于2022年1月21日發布“對我國《以藥動學參數為終點評價指標的化學藥物仿制藥人體生物等效性研究技術指導原則》中關于多規格豁免 BE藥學評價標準“處方比例相似性”相關問題的問答(試行)”[14],在該文件中明確了高活性藥物的標準為占比<5%�����。另外����,EMA及 WHO 均要求不同規格與 BE 批次有相同的制備工藝。
EMA�、WHO 還提出當多個規格間不符合處方相似的要求時�����,可采用括號法��,這樣僅進行兩端的兩個規格(如最高和最低規格�,或處方組成差異最大的 2 個規格)的體內 BE 試驗即可���,則剩余規格組成上的任何差異均可被上述兩個試驗覆蓋��。
3.2 第2種豁免
3.2.1 基本原則
無論基于 BCS I 類還是 III 類豁免 BE試驗���,均對輔料的選擇有所要求��。ICH M9提出,理想情況下����,受試制劑的輔料組成應模仿參比制劑����。但是���,若輔料存在差異���,應評價這些差異可能對體內吸收產生的影響�����。評價中應考慮藥物活性成分性質和輔料作用�����。對于片劑包衣中的較小用量或低于對特定藥物活性成分產生影響的已知閾值的用量����,可相對較少關注。
需注意的是,不管是 BCS I 類還是 III 類,ICHM9均規定可能影響吸收的輔料應種類相同且用量相似�,即在參比制劑輔料用量的±10% 范圍內且這些輔料的累計差異應在±10% 范圍內���。對于 BCSIII 類藥物而言�����,除了對影響吸收的輔料有要求外����,處方中其他輔料的種類也應相同���、用量相似�。
WHO 強調若某藥品中 1 個規格基于 BCS 豁免BE 試驗,則其他規格也必須基于 BCS 分類來評估是否可以豁免,而不是基于處方等比���;ICH還明確必須每個規格均與參比制劑比較來支持基于BCS分類豁免BE。
3.2.2 處方相似性判斷
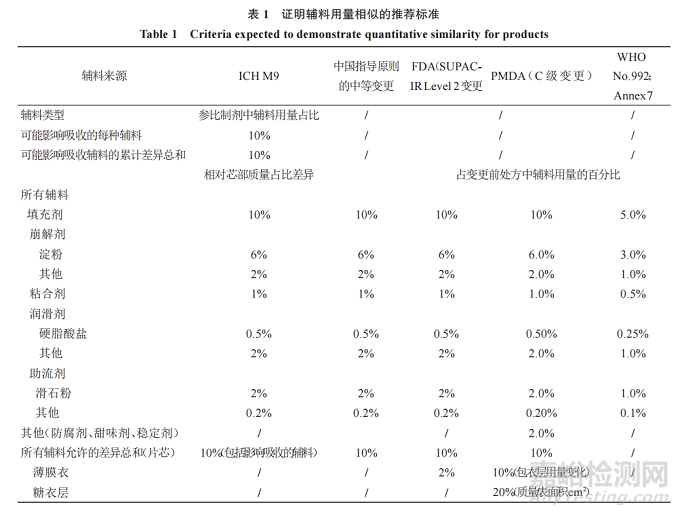
對基于 BCS分類豁免 BE試驗的各指導原則中對處方相似的判斷標準及各變更指導原則中申請豁免 BE對處方輔料用量變化的可接受范圍進行列表分析(表1)���。FDA基于BCS分類豁免 BE試驗的指導原則是由其變更指導原則延伸而來的,其處方相似性的判斷標準同 SUPACIR Level 2[2-3]的要求���,中國現行變更指導原則的中等 變 更[15]、ICH M9 及 PMDA[16-17]的 相 關 規 定 與FDA 大體是一致的(除對包衣的要求不同外)��。而WHO[11]的標準最為嚴格���,除未對包衣膜進行限定外����,其他同 FDA SUPAC-IR Level 1�,亦與我國的微小變更可接受范圍一致。
ICH M9 問答文件[10]解釋:芯部各輔料百分比差異是以相對仿制制劑與參比制劑各自的芯部進行計算����,若仿制制劑符合這些標準����,但輔料絕對質量存在很大差異(如仿制制劑與參比制劑的芯部質量不相似)�,可能須額外論證。
FDA變更指導原則指出�����,發生Level 2變更的藥物屬于高溶高滲(BCS I 類)�����、低溶高滲(BCS II 類)或高溶低滲(BCS III類)時��,若溶出度等滿足條件可不進行 BE 研究,否則應歸屬于 Level 3,需進行 BE試驗(或證實體內外具有相關性時可能會考慮豁免BE)��。
中國現行變更指導原則規定的中等變更與FDA 的 Level 2 變更相比����,除未限定薄膜衣的差異外,其他均一致��。而中國先前頒布的變更指導原則[18]對包衣液用量變更進行了解釋���,即:以原處方單劑量理論質量計算����,一般允許變更幅度為±2%且包衣液組成不能變化。PMDA 提出對于 C 級變更����,在藥物的溶解性和治療窗滿足規定時,若溶出等效則可視為生物等效 ��,否 則 需 根 據 仿 制 藥 BE 研 究 指 南[12]進 行 BE試驗�����。
總體上來看�,對于處方相似性的判斷�,不同指導原則主要對包衣膜的要求存在不同,ICH M9 在FDA 指導原則的基礎上����,刪除了包衣膜用量的控制�����,可能因為 BCS I和 III分類藥物制備的速釋制劑溶出均較快���,受包衣膜影響的可能性較小����,且包衣用量的準確測定亦存在一定困難���。而日本變更指導原則最大的不同在于其額外明確了含量較少的一些輔料(如防腐劑��、甜味劑��、穩定劑等)的變化量要求,并分別對薄膜衣和糖衣的組成和包衣質量/片芯表面積的變化進行了明確規定(變化水平將片芯和包衣層分開計算)���,將包衣層中輔料獨立計算的原因在于某種情況下包衣層影響藥品的溶出曲線,應考慮包衣的厚度而不是包衣層的質量�,因此在指定包衣層可接受變化的標準時有上述 2 個指標(包衣層組成變化和包衣質量/表面積比的變化)���。
另外,對于輔料不同等級(或型號)問題,ICHM9問答文件中說明:若適合�,應基于制劑中輔料的功能特性來評價輔料等級的差異��。對于一些輔料,等級改變可能會影響藥物制劑的溶出(如 HPMC粒度分布、黏度和取代度的改變����;硬脂酸鹽潤滑劑比表面積的改變)���。對于輔料相似性的評價�,需要具體情況具體分析���,以證明“種類相同”��。
關于處方相似性的計算方法�����,ICH M9 及日本指導原則中均給出了案例解析。
四�、對溶出曲線的要求
4.1 第1種豁免
各指導原則均明確要求不同規格制劑的體外溶出曲線相似���,EMA 規定溶出介質為 pH 1.2���、4.5���、6.8�,WHO 額外增加了質量控制(QC)介質(被藥典收載的)�����,各介質中溶出均需相似(除非經論證不滿足漏槽條件)。當不同規格因在上述介質中不滿足漏槽條件導致溶出不相似時���,需提供進一步研究資料來證實,如通過測試相同劑量的樣品(如2個5 mg的片劑 vs 1個 10 mg 的片劑)得出的溶出具備相似性 ���,或經試驗表明參比制劑具有相同的溶出行為。
4.2 第2種豁免
各監管機構曾實施的指導原則均對溶出曲線有具體要求��,ICH M9 主要在以下幾個方面進行了協調統一���。
(1)溶出介質種類 :另增了 1 個要求 ���,即“需在最低溶解度 pH(若與規定的 3 種緩沖液不同)下進行額外研究”���,同時強調了不應使用有機溶劑和添加表面活性劑�����。
(2)溶出介質體積:中國及FDA曾實施的指導原則分別為500 mL或更少����、500 mL或更少(經論證后可選擇 900 mL),ICH M9 統一為“900 mL或更少(建議使用質控(QC)檢測所選擇的體積)”
(3)槳法轉速:中國、FDA及WHO允許一定條件下采用75 r·min−1���,而ICH M9參照EMA的要求,僅允許采用50 r·min−1,并在M9問答文件中提到BCS I 類藥物預計不會發生高變異的情況,若發生變異、堆積��、黏附���、漂浮等現象 ��,建議經論證后采用籃 法 100 r·min−1 測 定 ���,而 未 說 明 可 以 提 高 槳 法轉速����。
關于溶出相似性評價���,各國指導原則的要求均相同�。BCS I 類藥物����,仿制制劑與參比制劑需具有快速溶出(30 min 內 API 的平均溶出百分比均能≥85%)的特點且相似(基于f2比較)。BCS III類藥物��,仿制制劑與參比制劑需具有非?��?焖偃艹龅奶攸c���,即在 15 min 內 API 的溶出均能達到標示量的 85%以上�。對于超過 1 種規格的制劑,仿制制劑和參比制劑的每個規格均應進行溶出曲線比較�����。
ICH M9問答文件中還明確���,對于BCS I類藥物預計不會發生溶出存在高變異的情況���,因此�����,不適宜采用替代統計方法證明相似性(如boost strapping法)�����。若因堆積效應產生高變異�,經科學論證,可考慮替代方法以解決堆積效應等問題�。溶出曲線相似性評價時��,應使用仿制制劑和參比制劑的12個制劑單位所得的溶出數據,報告每個獨立的制劑單位在每個特定的時間點的溶出量(以標示量的百分數表示)���,將平均溶出量 ,溶出范圍(高低值)和變異系數(相對標準偏差)列表呈現��;在進行 f2因子計算時�����,采樣點及相對標準偏差值需滿足要求���。
五�、結語
在 ICH 文件頒布前�����,不同監管機構有關 BE 豁免的指導原則技術要求均存在一定的差異����,本文主要對上述幾個關鍵藥學問題進行了探討。藥品研發時重點關注不同之處���,積極進行相關試驗研究,做出最科學嚴謹的選擇��。
5.1 參比制劑的選擇
各監管機構均明確參比制劑與仿制制劑的含量差值不超過 5%���,日本額外強調了參比制劑的含量需與標示量接近���;而對參比制劑批次的要求不盡相同���,但基本上均建議對多個批次的參比制劑進行研究���。ICH M9終稿中未對參比制劑的批次進行明確�����,可能是考慮到各國監管機構執行層面的差異,未作統一規定�����。若發現參比制劑的溶出等存在較大的批內或批間差異��,建議增加批次研究�����,對其質量有全面的了解,以選擇合理的批次。
5.2 處方工藝的要求
5.2.1 處方相似性的判斷
通過對比不同監管機構的指導原則及最終由 ICH 協調統一的過程中可以發現����,基于 BCS 分類申請豁免 BE 時輔料用量的可接受標準是由早期 FDA 頒布的變更指導原則發展而來的����,即基于近 30 年的實踐積累��,而非一蹴而就�����。日本界定藥品的變更等級時�����,分別對包衣膜組成和包衣質量與芯部表面積比進行了明確規定�,并給出了考察包衣對溶出曲線影響的方法(如采用水楊酸空白片進行試驗)����。研究者可結合參比制劑的實際包衣情況(如包衣組成、增重及包衣質量與片芯表面積比)�,考察包衣對溶出曲線可能存在的影響�����,同時結合藥品自身穩定性特點(對光濕等的敏感性)最終確定合理的包衣組成及增重,如對于光不穩定的藥物���,包衣的組成(是否含有遮光劑)及增重對強光下的穩定性影響較為顯著;對于易吸潮的藥 物 �����,包 衣 的 主 要 膜 材 ����、增 重 及 致 密 性 均 可 能影響片芯對水分的吸收程度。
ICH M9問答文件表明�,2個制劑中輔料的絕對質量應不存在很大差異�����,即芯部質量需具有相似性,但未明確具體標準��,FDA在第1種豁免指導原則中提出片芯質量差異在±10% 以內認為處方相似����,因此 10% 的標準可作為參考依據之一,但基于 M9中提出的理念“理想情況下��,受試制劑的輔料組成應模仿參比制劑����。”,建議研究者盡量選擇與參比制劑相近的芯重�����。亦如 WHO 提到的�����,對于仿制藥中輔料的選擇����,統一的原則就是�,越接近參比制劑,越容易豁免 BE 試驗����。在研發早期����,可以檢索各監管機構參比制劑的審評報告��、說明書及相關專利等以獲得全面詳細的處方信息��,或者運用一定的物理化學方法逆向解析參比制劑的處方,特別是可能影響溶出的輔料�����,為了獲得其準確用量�,建議對分析方法進行必要的驗證��。
5.2.2 生產工藝
針對第一種豁免�,EMA 及 WHO均要求不同規格與 BE批次有相同的制備工藝��。為避免不同的工藝或關鍵工藝參數可能導致的體內不等效風險�����,建議不同規格間采用相同的工藝,或參考中國現行的指導原則進行相關研究���。
5.3 溶出曲線
文中所述的QC方法,WHO解釋為已被藥典收載的方法,通常為有一定鑒別力的溶出方法���,EMA相關指導原則[19]對鑒別力的溶出方法定義為“方法可區分采用不同關鍵工藝參數和(或)關鍵物料屬性(可能對生物利用度有影響)所生產的不同批次樣品的能力。理想上所有不等效的批次均可被體外溶出方法監測出”。
基于BCS分類豁免BE對溶出曲線測定條件的要求中須注意到����,ICH M9 另增加了 1 個 QC 介質體積及1個最低溶解度pH值下的介質種類(若與規定的3種緩沖液不同)�����,且不可采用槳法75 r·min−1。
另外����,在中國若新增藥品規格���,需按補充申請的途徑申報�����,藥審中心于 2022 年 11 月發布《〈已上市化學藥品藥學變更研究技術指導原則(試行)〉中溶出曲線研究的問答》[21],給出了新增規格溶出曲線研究的具體建議��。
本文分析不同監管機構先前實施的法規與最終協調一致的ICH 指導原則存在的差異�,了解指導原則的起草�����、頒布及后續不斷完善的整個過程��,更能深刻的理解其背后的科學依據���,對研發高質量藥品起到事半功倍的作用�。同時提醒申請人注意�,ICH 僅是在技術層面進行協調統一,其允許在仿制藥申請中存在地區性差異(如日本因參比制劑處方難以獲得、暫不適用于仿制藥)�,EMA明確基于BCS分類的豁免尚未在全球內達成共識�,申請人須遵循當地法規���。