您當前的位置:檢測資訊 > 法規標準
嘉峪檢測網 2022-11-29 17:51
2022年4月份,國家市場監督總局國家標準化管理委員會批準頒布的一批國家標準,其中就包含醫療器械生物學評價(GB/T16886.1-2022)的第一部分:風險管理過程中的評價與試驗,它是整個生物學評價通用標準體系里的總綱。所以這份標準的變化對企業會有很大的影響,新標準實施后(2023.05.01 實施)生物學評價的要求變的更嚴格了,現在處于過渡期,但是在過渡期階段,也建議大家按照新的標準來開展生物學評價工作。因為有些生物學評價實驗需要進行的測試時間會很長,等做完試驗新標準就已以開始實施了。
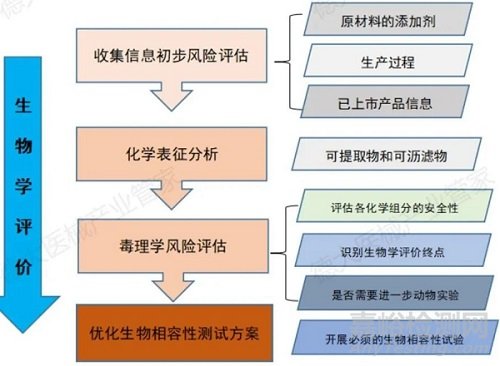
生物學評價過程需通過一個多種途徑評估進行,首先要收集產品有關的信息進行初步的風險評估,收集擬使用的原材料、生產過程信息、生產過程中使用的添加劑、生產中可能包含的雜質、市面上已經銷售的同類產品的信息。收集到這些信息之后我們可以做一個初步的風險評估。第二階段就是化學表征的分析,這也是新版的生物學評價當中必做一項,通過可提取物和可瀝濾物對化學表征進行分析。將得到數據會交給毒理學家,進行毒理學的風險評估,評估各個化學組分的安全性,去識別生物學評價的終點,分析是否需要進一步的動物實驗。基于以上的三步以后,對生物相容性測試方案進行優化,根據不同種類的醫療器械需要的評價終點來開展必須的生物相容性測試。
化學表征和毒理學的風險評估階段,那些毒理學評估可以代替那些動物實驗呢, 參考 ISO 10993-1:2018Table A.1,有7個系統性毒性試驗,包括急性毒性試驗、亞急性毒性試驗、亞慢性毒性試驗、慢性毒性試驗、遺傳毒性試驗、致癌性試驗、生殖發育毒性試驗這7種,是可以通過化學表征加毒理學風險評估的方法來覆蓋評估它生物學評估終點。使用毒理學風險評估的方法與常規的生物學評價比較它有什么優點呢,因為上述毒理學試驗的周期都比較長,短則一個月,長則 1-2 年,檢測費用也非常高,如果使用化學表征加毒理學評估的方法來評估這些生物相容性終點的話,可能在少于3個月的時間就可以結束。節省大量的時間和費用。

生物學評價報告的內容,完成一個生物學評價報告首先要制定一個生物學評價計劃,根據產品的具體要求去設置一個計劃,根據計劃來進行風險評價和相關的測試,最后形成一個生物學評價報告。
首先去制定一個生物學評價策略和程序,確定相關材料和預期用途,確定可接受標準。然后去獲取材料化沉迷表征的數據,根據化學表征的毒理學風險評估結果去選擇或豁免一些評價終點,根據已有的數據和實驗結果現去收集一些生物學評價所需的其它數據。根據這些數據來得到一個總體的生物學安全性的結論。
報告中要包含商品名稱、所用標的名稱。在評價報告中列出產品的配方信息,化學名稱、供應商及商品名,每種材料的百分比,化學成分的功能。還要提供產品生產工藝,明確加工方法,如果使用注塑成型,就需要提供注塑的工藝參數,時間、溫度、壓力等等。在加工過程中使用的添加劑或者避免使用添加劑,以及已知的雜質。如果產品是一個最終滅菌產品,例如使用了v射線、蒸氣、環氧乙烷滅菌,則需要提供滅菌相容性的研究信息。
化學表征,根據 ISO 10993-18 部分進行化學表征的分析。需要可瀝濾物的分析包括在進行萃取時的溶劑、溫度、溶解度等條件,來獲取化學表征數據,由毒理學家進行評估。對于一些做血液相容性相關的產品還要參考 ISO TS 10993-19 的表面特征描述方法,因為醫療器械的零部件的形狀和相關的排列構造(光滑或粗糙)都會對相容性評價結果有一定的影響。這也是需要考慮到的。最后就是對材料供試品進行生物相容性研究,一些不能豁免的和無法評估的進行實際測試,進行一些體內體外的測試,根據器械接觸患者的類型、接觸時間來判斷它的生物學評價的終點,進行一些相關的試驗,比如說細胞毒性、熱原、全身毒性、血液相容性試驗等。試驗中要明確供試品是什么,尺寸、滅菌周期、數量。使用樣品的萃取條件,時間、溫度、比例等對樣品進行浸提。在報告中也要提交相關體內、體外試驗的報告,包括試驗方法、結果和結論。綜上所述,這些就是生物相容性評價報告所包含的一些內容。

來源:德大器械產業管家


