您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2022-09-23 10:50
更多醫藥技術資訊,請點擊醫藥專欄:http://drug.anytesting.com/ 歡迎關注文末微信公眾號:藥研檢測drugtest
今日頭條
揚子江G蛋白靶向鎮痛藥獲批臨床。揚子江旗下公司上海海雁醫藥開發的YZJ-4729酒石酸鹽注射液1類化藥獲國家藥監局臨床默示許可,擬用于需要使用靜脈注射阿片類藥物的成人患者急性疼痛。YZJ-4729是一款G-蛋白偏向性μ阿片受體(MOR)激動劑,可選擇性激活G蛋白通路發揮強效鎮痛作用,同時避免激活β-arresti-2通路以減輕呼吸抑制和胃腸功能障礙等阿片類藥物不良反應。目前,同類藥物全球僅有Trevena公司的Olinvyk(奧賽利定,TRV130)獲批上市,該新藥已在國內遞交上市申請。
國內藥訊
1.奧拉帕利在華獲批卵巢癌新適應癥。阿斯利康與默沙東聯合開發的PARP抑制劑奧拉帕利(Lynparza)獲國家藥監局批準新適應癥,用于HRD陽性、晚期上皮性卵巢癌、輸卵管癌或原發性腹膜癌成人患者在一線含鉑化療聯合貝伐珠單抗治療達到完全緩解或部分緩解后的維持治療。在III期PAOLA-1研究的HRD陽性亞組分析中,奧拉帕利聯合貝伐珠單抗組患者的中位無進展生存期(PFS)達46.8個月,而貝伐珠單抗組的中位PFS僅為17.6個月;聯合治療使疾病進展或死亡風險降低67%(95%CI:0.25-0.45)。
2.鹽酸哌甲酯新劑型在華報兒童多動癥NDA。國家藥監局受理祐兒醫藥與Tris Pharma公司申報的鹽酸哌甲酯口服緩釋干混懸劑的5.1類新藥上市申請。這是一款中樞神經系統(CNS)興奮劑,該新藥的兩種劑型鹽酸哌甲酯口服緩釋干混懸劑(Quillivant XR)和鹽酸哌甲酯緩釋咀嚼片(QuilliChew ER)均已在海外獲批用于治療注意缺陷多動障礙(ADHD,俗稱多動癥),它們可在45分鐘內起效,有效控制多動癥癥狀。今年7月,CDE已將鹽酸哌甲酯緩釋咀嚼片的上市申請納入優先審評。
3.康寧杰瑞HER2雙抗ADC上Ⅰ期臨床。康寧杰瑞HER2雙特異性抗體偶聯藥物JSKN003(KN026-ADC)在澳大利亞針對晚期實體瘤開展的Ⅰ期臨床首例患者給藥。JSKN003是康寧杰瑞自主研發,基于HER2雙抗KN026,利用糖基定點交聯的抗體偶聯藥物。在臨床前研究中,JSKN003顯示出較同類藥物具有更好的血清穩定性、旁觀者殺傷效應和腫瘤殺傷活性,預期有更寬的治療劑量窗。
4.樂普EGFR靶向ADC擬納入突破性療法。樂普生物注射用MRG003獲CDE擬納入突破性治療品種,用于治療既往經至少二線系統化療(包括含鉑化療)和PD-1(L1)治療失敗的復發/轉移性鼻咽癌(NPC)。MRG003是一款靶向EGFR的抗體偶聯藥物(ADC),通過抗體部分將細胞毒小分子精準遞送至腫瘤細胞中,以導致腫瘤細胞死亡。在美國,MRG003用于R/M NPC適應癥已獲得FDA授予孤兒藥資格。
5.正大天晴超3億引進NASH新藥。中國生物制藥旗下正大天晴與Inventiva公司就后者臨床期泛PPAR激動劑候選藥物lanifibranor達成合作許可協議,正大天晴將獲得lanifibranor在大中華區(中國大陸、香港、澳門和臺灣)用于非酒精性脂肪性肝炎(NASH)和潛在的其他代謝疾病的開發和商業化授權。根據協議,Inventiva將獲得1200萬美元的預付款,可能高達2.9億美元的臨床、監管和商業里程碑潛在付款。
國際藥訊
1.全球首款預防耳毒性新藥獲批上市。Fennec公司硫代硫酸鈉注射液(Pedmark)獲FDA批準上市,成為首款藥物,用于降低1個月及以上局部非轉移性實體瘤的兒童患者因順鉑所致的聽力損失。Pedmark在順鉑化療約6小時后使用,能使在血漿中循環并造成聽力受損的順鉑代謝副產物失活。此前,FDA已授予Pedmark孤兒藥資格、快速通道資格、突破性藥物資格。
2.禮來不限癌種RET抑制劑獲FDA加速批準。FDA加速批準禮來(Eli Lilly)RET抑制劑Retevmo(selpercatinib)擴展適應癥,用于治療RET基因融合的局部晚期或轉移性實體瘤患者。FDA同時將Retevmo用于RET基因融合的局部晚期或轉移性非小細胞肺癌(NSCLC)的加速批準轉為完全批準。在關鍵性LIBRETTO-001臨床中,Retevmo在不限癌種患者隊列中達到44%的總緩解率,中位緩解持續時間為24.5個月,67%的患者緩解持續超過6個月。
3.優時比IL-17A/F單抗在歐洲報新適應癥。歐洲藥品管理局(EMA)受理UCB公司IL-17A/F單抗bimekizumab的兩項上市許可申請,用于治療成人活動性銀屑病關節炎和活動性中軸型脊柱關節炎患者。bimekizumab是全球首款獲批上市的IL-17A/F抗體藥物,已于2021年8月在歐盟和英國獲批上市,商品名為BIMZELX,用于治療中重度斑塊狀銀屑病成人患者。除bimekizumab外,同類藥物在研還有鑫康合/麗珠醫藥的LZM012和羅氏/Novimmune的afasevikumab。
4.抗真菌新藥雷扎芬凈獲優先審評資格。Cidara公司新型棘白菌素Rezafungin用以治療念珠菌血癥(candidemia)與侵襲性念珠菌病(invasive candidiasis)的新藥申請(NDA)獲FDA授予優先審評資格,預計明年3月22日前將獲得回復。rezafungin具有較長的半衰期,可每周給藥1次。在Ⅲ期臨床ReSTORE中,rezafungin治療組在系統治愈率方面非劣效于caspofungin(每天注射)組。該新藥上個月已在歐盟報產。
5.默沙東擬開展HIV新藥III期臨床。默沙東宣布將開展長效核苷逆轉錄酶易位抑制劑islatravir (ISL,MK-8591)與非核苷逆轉錄酶抑制劑Doravirine(0.75 mg)聯合治療HIV-1感染患者的一項新的III期臨床。該項試驗將包括一項用于評估這一組合用于HIV-1感染初治患者的研究以及兩項用于評估聯合治療在接受抗逆轉錄病毒治療(ART)后獲得病毒學抑制的HIV患者中的研究。默沙東同時宣布,將終止islatravir每月口服用于暴露前預防 (PrEP) 的開發。
6.輝瑞兩款口服GLP-1受體激動劑臨床積極。輝瑞日前公布兩款口服小分子GLP-1受體激動劑(danuglipron和PF-07081532)在治療2型糖尿病的最新臨床數據。在Ⅱb期臨床中,Danuglipron能顯著降低患者16周后的糖化血紅蛋白(HbA1c)水平,最高兩個劑量組HbA1c較基線分別降低0.96和1.18個百分點;最高劑量組平均體重降低接近10斤,且沒有達到平臺期。PF-07081532在2型糖尿病和肥胖癥患者中進行的Ⅰb期臨床結果顯示,患者接受PF-07081532治療6周后,其空腹血糖水平接近正常閾值;最高劑量組體重較基線降低約10斤。此外,兩款藥物的安全性與同類藥物相似。
醫藥熱點
1.齊魯醫院造血干細胞移植新病區啟用。9月17日上午,山東大學齊魯醫院造血干細胞移植新病區正式啟用。此次新病區投入使用百級層流倉16間,使該醫院造血干細胞移植病區百級層流倉達到21間,成為山東省規模最大的造血干細胞移植診療科室,預計每年移植量將達到300余人次,能更好地滿足日益增長的惡性血液病患者造血干細胞移植治療需求。
2.我國擬加強兒童中醫藥健康管理。國家衛健委日前印發《健康中國行動中醫藥健康促進專項活動實施方案》指出,將開展青少年近視、肥胖、脊柱側彎中醫藥干預活動。在中醫醫院以及基層醫療衛生機構推廣使用耳穴壓丸等中醫適宜技術,對兒童青少年近視進行早防早控;組織中醫藥防控兒童青少年肥胖、脊柱側彎健康教育活動,引導兒童青少年養成良好生活習慣。加強基本公共衛生服務兒童中醫藥健康管理,力爭到2025年,兒童中醫藥健康管理率達到85%。
3.香港將對高風險人群接種猴痘疫苗。香港衛生署日前公布,高風險群組接種猴痘疫苗計劃將于10月5日起展開,10月3日起可預約。7月起,我國臺灣和香港地區相繼出現4例境外輸入性猴痘確診病例,不久前重慶亦首次發現輸入性猴痘病例。據世衛組織報告顯示,從1月1日至9月15日期間,全球累計報告了60320例猴痘確診病例,累計報告23例猴痘死亡病例。
評審動態
2. FDA新藥獲批情況(北美09月21日)
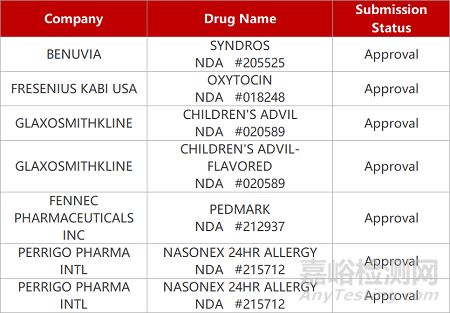

來源:藥研發


