您當(dāng)前的位置:檢測資訊 > 科研開發(fā)
嘉峪檢測網(wǎng) 2021-06-15 08:57
更多醫(yī)藥技術(shù)資訊,請點(diǎn)擊醫(yī)藥專欄:http://drug.anytesting.com/ 歡迎關(guān)注文末微信公眾號:藥研檢測drugtest
「 本文共:16條資訊,閱讀時(shí)長約:3分鐘 」
今日頭條
綠葉治療抑郁癥新藥國內(nèi)報(bào)NDA。綠葉制藥1類新藥鹽酸安舒法辛緩釋片(LY03005)用于治療抑郁癥的上市申請獲CDE受理。LY03005是一種5-羥色胺(5-HT)、去甲腎上腺素(NE)和多巴胺(DA)三重再攝取抑制劑,為同類首創(chuàng)產(chǎn)品。在臨床研究中,LY03005不僅可改善患者的抑郁癥狀,而且總體耐受性、安全性良好。目前,LY03005在美國也進(jìn)入新藥上市申請階段,在日本完成I期臨床試驗(yàn)。
國內(nèi)藥訊
1.百時(shí)美施貴寶O+Y免疫組合國內(nèi)獲批。NMPA批準(zhǔn)百時(shí)美施貴寶CTLA-4伊匹木單抗(逸沃®)上市,聯(lián)合PD-1納武利尤單抗(歐迪沃®)用于初治的不可切除非上皮樣型惡性胸膜間皮瘤成人患者。伊匹木單抗是國內(nèi)首款獲批的CTLA-4單抗,該組合療法也是國內(nèi)獲批的首個(gè)雙免疫療法。在一項(xiàng)Ⅲ期臨床CheckMate-743研究中,與標(biāo)準(zhǔn)護(hù)理化療(培美曲賽+順鉑或卡鉑)相比,這一組合顯著改善患者的總生存期。
2.杭州朗煜哮喘新藥啟動國際II期臨床。朗煜醫(yī)藥治療中重度哮喘新藥Cavosonstat(N91115)在美國啟動II期臨床患者招募工作。這是一項(xiàng)國際II期臨床,將在英國、美國以及中國等地區(qū)開展。Cavosonstat是一種新型CFTR調(diào)節(jié)劑,已在I期臨床中顯示出良好的安全性,最大單日給藥劑量可達(dá)1600mg;而且試驗(yàn)過程中無SAE發(fā)生,未發(fā)現(xiàn)劑量依賴性毒性,所有AE均為輕度。
3.石藥集團(tuán)抗腫瘤新藥國內(nèi)獲批臨床。石藥集團(tuán)中奇制藥開發(fā)的大環(huán)內(nèi)酯抗生素類免疫抑制劑「注射用西羅莫司(白蛋白結(jié)合型)」獲國家藥監(jiān)局臨床試驗(yàn)?zāi)驹S可,擬開發(fā)用于治療實(shí)體瘤和血液瘤。西羅莫司是輝瑞開發(fā)的一種mTOR特異性抑制劑,臨床上用于預(yù)防接受腎移植患者的器官排斥。目前已上市的西羅莫司均為口服制劑,尚無注射給藥劑型。
4.勤浩KRAS抑制劑國內(nèi)獲批臨床。勤浩醫(yī)藥1類新藥GH35片獲國家藥監(jiān)局兩項(xiàng)臨床試驗(yàn)?zāi)驹S可,擬開發(fā)用于晚期實(shí)體瘤的治療。GH35是一款KRAS G12C抑制劑,已在臨床前研究中顯示出對KRAS G12C突變具有高選擇性和極強(qiáng)的生物活性;而且對野生型KRAS以及安全性相關(guān)的靶點(diǎn)無顯著影響,脫靶風(fēng)險(xiǎn)低;該新藥同時(shí)還具有代謝性質(zhì)優(yōu)異、口服生物利用度高、安全性良好等特點(diǎn)。
5.貝達(dá)巴替利單抗國內(nèi)獲批臨床。貝達(dá)藥業(yè)與Agenus公司合作開發(fā)的PD-1單抗巴替利單抗(Balstilimab)獲國家藥監(jiān)局臨床許可,擬用于晚期宮頸癌的治療。Balstilimab是貝達(dá)藥業(yè)從Agenus公司引進(jìn)的2款單抗產(chǎn)品之一,另一款是CTLA-4單抗Zalifrelimab。在美國,Agenus已于去年9月向FDA遞交巴替利單抗上市申請并獲FDA快速通道資格,單藥或聯(lián)合Zalifrelimab用于治療晚期/轉(zhuǎn)移性宮頸癌。
國際藥訊
1.強(qiáng)生新冠疫苗有效期獲FDA批準(zhǔn)延長。FDA批準(zhǔn)強(qiáng)生新冠疫苗有效期延長六周,由原先的3個(gè)月改為4個(gè)半月。據(jù)悉,這將有助于緩解對于數(shù)百萬劑即將到期的強(qiáng)生疫苗的擔(dān)憂,將使各州有更多時(shí)間為民眾接種疫苗。強(qiáng)生在一份聲明中表示,有效期獲批延長是基于正在進(jìn)行的穩(wěn)定性評估研究的數(shù)據(jù),這些研究表明,在華氏36-46度的溫度下冷藏時(shí),疫苗可穩(wěn)定保存4.5個(gè)月。
2.印度新冠疫苗在美EUA被拒。FDA拒絕批準(zhǔn)印度巴拉特公司新冠滅活疫苗Covaxin的緊急使用授權(quán)(EUA),F(xiàn)DA要求其提供更多額外的臨床試驗(yàn)數(shù)據(jù)。該公司的美國合作伙伴Ocugen公司10日表示,將不再尋求Covaxin的緊急使用授權(quán),而打算申請?jiān)撘呙缭诿绹娜媾鷾?zhǔn)。據(jù)悉,該疫苗此前在巴西被查出存在生產(chǎn)缺陷,它跳過了確保疫苗中新冠病毒被完全殺死的步驟。
3.GRAIL推出多癌種早篩血檢。GRAIL公司宣布在美國推出癌癥早篩血檢Galleri,作為處方檢測,針對高危人群用于50多種癌癥的篩查。公布于ASCO2021年會上的干預(yù)性PATHFINDER研究的首批結(jié)果顯示,Galleri的陽性預(yù)測值(PPV)為44.6%(95% CI: 33.2-56.7%);在確診患者中預(yù)測癌癥起源的準(zhǔn)確率達(dá)到96.3%;在13種癌癥中能準(zhǔn)確檢測I-II期階段、I-III期階段的比例分別達(dá)到9/23和13/23。最終結(jié)果預(yù)計(jì)在2022年上半年獲得。
4.CD19靶向CAR-T療法Ⅲ期臨床積極。百時(shí)美施貴寶公司(BMS)靶向CD19的自體CAR-T細(xì)胞療法Breyanzi(lisocabtagene maraleucel)在Ⅲ期臨床中達(dá)到主要終點(diǎn)與關(guān)鍵次要終點(diǎn),與標(biāo)準(zhǔn)治療相比,顯著改善復(fù)發(fā)/難治性大B細(xì)胞淋巴瘤(LBCL)患者的無事件生存期,完全緩解率和無進(jìn)展生存期。安全性方面與先前研究結(jié)果一致。今年2月,F(xiàn)DA已批準(zhǔn)Breyanzi用于治療接受過兩種或以上系統(tǒng)治療的R/R LBCL成人患者。
5.羅氏口服SMA療法最新臨床結(jié)果積極。羅氏開發(fā)的口服創(chuàng)新脊髓性肌萎縮癥(SMA)療法Evrysdi(risdiplam)在兩項(xiàng)臨床研究中(JEWELFISH和RAINBOWFISH)獲得積極結(jié)果。最新數(shù)據(jù)表明,在經(jīng)治的1至60歲患者中,Evrysdi將SMN蛋白水平提高兩倍以上,安全性與之前研究保持一致。此外,癥狀出現(xiàn)前就開始接受治療的2個(gè)月以下SMA嬰兒,在接受Evrysdi治療至少12個(gè)月后達(dá)到了與年齡一致的運(yùn)動里程碑以及運(yùn)動功能的改善。risdiplam的監(jiān)管申請?jiān)谥袊驯患{入優(yōu)先審評,有望在今年獲得批準(zhǔn)。
6.CRISPR基因編輯療法最新臨床積極。Vertex Pharmaceuticals和CRISPR Therapeutics聯(lián)合開發(fā)的CRISPR/Cas9基因編輯療法CTX001在兩項(xiàng)臨床研究中獲積極數(shù)據(jù)。在用于治療患有輸血依賴性β地中海貧血患者的CLIMB-111臨床中,所有15例患者在最近一次隨訪時(shí)均不再依賴輸血,總血紅蛋白水平(8.9g/dL-16.9g/dL)和胎兒血紅蛋白占比(67.3%-99.6%)均顯示出顯著的改善。在治療嚴(yán)重鐮刀型細(xì)胞貧血病患者的CLIMB-121臨床中,所有7例患者均無血管閉塞危象,血紅蛋白水平(11g/dL-15.9g/dL)和胎兒血紅蛋白占比(39.6%-49.6%)均具有統(tǒng)計(jì)學(xué)意義的改善。
7.禮來與ALX合作開發(fā)胃癌組合療法。ALX Oncology下一代CD47檢查點(diǎn)抑制劑ALX148擬聯(lián)合禮來VEGFR2抗體Cyramza開展一項(xiàng)Ⅱ/Ⅲ臨床研究,評估ALX148聯(lián)合Cyramza、曲妥珠單抗、紫杉醇用于治療HER2陽性胃癌或胃食管交界癌患者的療效。在美國,F(xiàn)DA之前已授予ALX148兩個(gè)快速通道資格:ALX148聯(lián)合Keytruda+5FU+鉑類藥物治療頭頸部鱗狀細(xì)胞癌;以及ALX148聯(lián)合曲妥珠單抗+Cyramza+紫杉醇,治療胃癌或胃食管交界癌。
醫(yī)藥熱點(diǎn)
1.中日友好醫(yī)院將建大器官移植中心。中日友好醫(yī)院副院長劉勇日前在器官移植工作會議上透露,該院已具備肝臟、腎臟、心臟、肺移植資質(zhì),成立了包含普外科、泌尿外科、胸外科、重癥醫(yī)學(xué)科等多學(xué)科的院級器官移植中心;計(jì)劃在“十四五”期間打造國家級大器官移植中心。目前,該院正在與中山大學(xué)附屬第一醫(yī)院何曉順教授團(tuán)隊(duì)合作,旨在利用新技術(shù)手段修復(fù)離體器官以達(dá)到器官移植要求。
2.世衛(wèi)重檢意大利2019年血樣。意大利米蘭國家腫瘤研究所9日宣布,他們已向世衛(wèi)組織提供了2019年采集的含新冠病毒抗體的血液樣本,結(jié)果可能將證實(shí)他們的推斷——新冠病毒在2019年就已經(jīng)在意大利傳播。送檢的血液樣本采集于2019年10月至12月間。世衛(wèi)組織指定了荷蘭的一家實(shí)驗(yàn)室進(jìn)行重新檢測。此次檢測結(jié)果將證明該國官方公布(2020年2月21日)首例本土新冠確診病例之前,病毒是否已在意大利傳播。
3.居民醫(yī)保進(jìn)一步放開參保戶籍限制。國家醫(yī)保局發(fā)布《關(guān)于做好2021年城鄉(xiāng)居民基本醫(yī)療保障工作的通知》。《通知》提出,進(jìn)一步放開參加基本醫(yī)療保險(xiǎn)的戶籍限制,對于持居住證參加當(dāng)?shù)爻青l(xiāng)居民醫(yī)保的,各級財(cái)政要按當(dāng)?shù)鼐用裣嗤瑯?biāo)準(zhǔn)給予補(bǔ)助;規(guī)范待遇享受等待期設(shè)置,對居民醫(yī)保在集中參保期內(nèi)參保的、在職工醫(yī)保中斷繳費(fèi)3個(gè)月內(nèi)參加居民醫(yī)保的,以及新生兒、農(nóng)村低收入人口等特殊群體,不設(shè)等待期。
審評動向
1. CDE新藥受理情況(06月10日)
申請臨床:
江蘇威凱爾的VC005片(4個(gè)規(guī)格)、百濟(jì)神州的替雷利珠單抗注射液、成都可恩生物的卡介菌純蛋白衍生物。
申請生產(chǎn):
山東綠葉的鹽酸安舒法辛緩釋片(2個(gè)規(guī)格)。

2. FDA新藥獲批情況(北美06月10日)
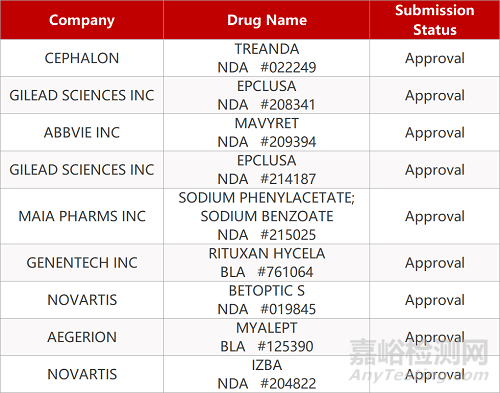

來源:藥研發(fā)


