您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-04-27 14:17
QbD是一個科學技術及質量風險管理相結合的系統性研發方法,它始于預先制定好的目標,強調對產品和生產工藝的理解及控制。QbD從患者對藥品的臨床需求著手,先確定藥品質量的目標概況(QualityTargetProduct Profile,QTPP),形成產品開發設計的基礎。
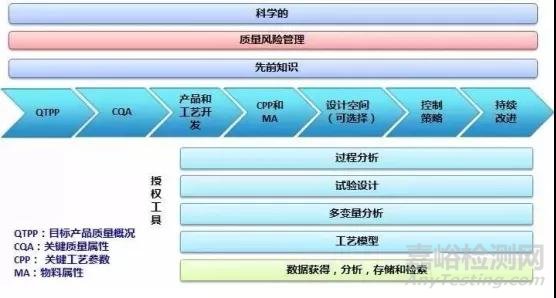
QTPP是QbD的基本元素,是從理論上進行前瞻性總結某個產品的質量屬性,以確保最終藥物在臨床上的安全性與有效性。QTPP 主要考慮臨床使用條件、給藥途徑、劑型和藥物傳遞系統、藥動學參數或生物等效性、劑量規格、藥品包裝材料和形式等因素。
舉個例子
對于一個注射劑,需要考慮:在臨床使用時是否需要溶于溶液稀釋后再給藥?稀釋溶液pH是否會影響藥物穩定性?如果該藥品是滴注給藥,那么多長時間放置,可以保證藥物的穩定性?還要考慮到:如果病床靠近窗口,在太陽的照射下,滴注樣品仍然需要穩定等。QTPP通常需要公司的各部門一起討論,并由各部門批準。除了制劑開發部門,還包括臨床研發部門、臨床前研究(藥代和毒理研究)部門、藥事法規部門、工業生產部門等,如果從藥品研發初始階段就在腦海中形成QTPP的概念,那么,最終我們可獲得一個穩健的處方及生產工藝,并且能保產品的關鍵質量屬性。
QTPP明確之后,便要查詢相關資料,或開展試驗來確定藥物的理化和生物學性質(即處方前研究),再結合醫學、市場、運營、法規需求,確定生產出質量穩定、療效可靠產品的關鍵質量屬性(CriticalQuality Attributes, CQA)。關鍵質量屬性反映的是成品在內的產出物料(中間體)的某種物理、化學、生物學等性質或特征,當這一性質或特征在一個適當的限度、范圍或分布內,才能確保預期的產品質量。對口服固體制劑(oral soliddosage,OSD)質量屬性包括其有效成分鑒別、含量、含量均勻度、降解產物、殘留溶劑、藥物釋放或溶出度、水分含量、微生物限度,以及物理屬性,如顏色、形狀、大小、氣味、產品刻痕和脆碎度等。在這個過程中,會形成CQA報告,關鍵質量屬性的認定需要得到整個開發團隊(藥企各部門)的認可。根據這些關鍵質量屬性和處方前研究報告,制劑開發團隊將起草制劑產品開發策略,在得到制劑部門管理層認可后,進入產品開發階段。
OSD藥品的這些質量屬性可以是關鍵的質量屬性(critical quality attributes,CQA),也可以是非關鍵性的。一個質量屬性是否關鍵,取決于當該屬性超出可接受范圍時對患者引起的傷害程度,應該依據化合物的特性和制劑劑型的特點確定制劑產品的關鍵質量屬性(CQA)。
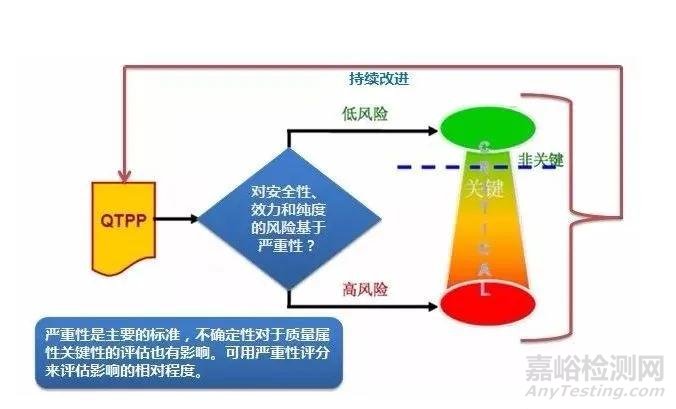
QbD中對QTTP和CQA的研究確定是圍繞患者的需求和對患者產生的影響來決定,并以臨床療效和安全為目標。QTPP與CQA可以是包含關系,從QTPP中挑選出CQAs的關鍵在于如果某種屬性超出了范圍時,由風險評估獲得的該屬性對病人是否有重大影響。
對于仿制藥而言,QTTP和CQA通常是通過研究參比制劑的說明書以及參比制劑的質量屬性等來確定。參比制劑的研究包括但不限于以下內容:了解參比制劑的適應癥、適用人群、用法用量、最大日劑量、藥理作用、藥動學以及輔料成分等;進行必要的逆向工程研究參比制劑可能的處方組成和工藝;進行必要的檢驗從而了解參比制劑的各項質量屬性如含量、雜質、有機殘留、水分、硬度、崩解及溶出等。
小試開發
產品開發首先要在小試規模進行。由于在這個時期的原料藥來源非常有限,制劑開發通常以配方研究為主,伴以手工制備。主要根據物理藥劑理念,探索哪些原料藥的性質、輔料性質以及不同制劑概念將會對制劑產品的關鍵質量屬性有顯著影響,同時對技術瓶頸攻關。對于一些新型制劑的功能需求,還需考慮添加功能輔料。需要注意的是,功能輔料的選擇必須在FDA公布的“質”和“量”的范圍。
工藝開發
在小試開發基本達到開發要求,所制備的產品基本符合產品關鍵質量屬性要求后,制劑開發工作進入工藝開發階段。在此過程,主要是根據產品關鍵質量屬性,確定生產工藝路線,同時根據工藝的需求調整輔料。工藝開發的主要成果是確認關鍵工藝步驟及其工藝參數范圍。值得一提的是,在制劑開發過程中,隨時需要考慮產業化的可行性。比如,制劑研發人員應盡量選用成熟、重現性好、簡單、低成本工藝。選擇的工藝及設備需要得到生產部門的確認,所選擇的輔料需與生產部門一致。筆者的經驗是,制劑開發部門最好使用生產部門的輔料進行處方開發和工藝開發,選擇的生產工藝及設備需要考慮生產部門的可行性。比如筆者曾經歷過的情況,由于日本與美國對PEG6000的定義不同,同一公司內部不同部門使用不同輔料,造成技術轉移時出現困惑。所以,若不關注輔料來源,必然會影響到研發階段與上市后批量生產時產品的質量差異。
工藝放大
在制劑產品的工藝路線確定后,產品開發進入工藝放大階段。在這個階段,主要根據中試生產和商業生產批次規模,對關鍵工藝參數進行優化,同時也會根據工藝的需求進一步調整輔料;也運用數學模型、統計方法等(如可能,運用在線分析系統PAT),確認關鍵工藝步驟及其參數范圍,在此過程中還有必要在關鍵工藝步驟的參數范圍邊緣生產批次;確認關鍵工藝步驟所可能產生的風險,并建立風險控制步驟。
技術轉移
制劑開發的最終目的是將所開發的產品處方和工藝移交給生產部門進行生產,這個制劑研發部門與制劑產品生產部門的交接過程,稱為技術轉移。通常,技術轉移首先需要起草技術轉移方案,應根據公司規定的模版,先由制劑研發部門起草,然后由生產部門審閱,并由雙方簽字確定。如生產工藝比較復雜,可由研發部門進行預生產一定的批次量,再轉移給生產部門。技術轉移一般生產三批:第一批由研發人員負責生產,稱為演示批;第二批由雙方共同負責生產,稱為交接批;第三批由生產部門負責生產,稱為驗收批。
后記
所有的質量屬性都是產品的目標元素,這些屬性可以是關鍵性的,也可以是非關鍵性的;但它們均應該通過一系列好的質量管理體系、合適的處方、以及工藝設計來獲得。在藥物研發過程中,我們一般僅關注那些會受處方、工藝影響較大的一些CQAs。

來源:Internet


