您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2020-12-01 14:20
病毒清除是生物制藥產品病毒安全性的基本方面。世界各地的監管機構要求生物制藥企業適當地隔離其制造過程,以減輕來自生產工藝步驟或產品批次的殘留污染以及同一工廠生產的產品之間交叉污染的風險。法規在定義“適當”時含糊不清,使生物制藥企業可以解釋監管要求并定義自己的除病毒工藝和隔離策略。考慮到制造工藝和容納此類操作的設施之間的差異,因此看到不同企業采用了一系列隔離策略也就不足為奇了。
在此,我們提供了一系列可操作的病毒隔離策略,在設計生物制藥設施時可以考慮這些策略。也討論了在許多多系統中使用的CIP系統造成交叉污染的可能性。
單克隆抗體(MAb)已被證明是治療多種疾病的有價值的生物藥物。這些復雜的分子通常由重組哺乳動物細胞系產生,例如在培養物中表達所選抗體的中國倉鼠卵巢(CHO)細胞。許多這樣的細胞系表達逆轉錄病毒樣顆粒(RVLP)。它們被分泌到培養基中,被認為是與過程有關的雜質。
當前的法規指南要求從最終的純化MAb產品中去除RVLP,其功效與感染性病毒相類似。根據ICH Q5A文件,對除病毒能力的要求是:“整個純化過程應能夠消除比單劑量未處理樣品中估計存在的病毒還要多的病毒”。指南也提供了一個示例,說明如何計算有關每劑生物制藥產品潛在RVLP的安全閾值,以每劑估計顆粒(EPD)表示。
該計算的結果是每10劑中有一個可能的顆粒,該限量現已被認為是RVLP去除的最小目標。RVLP可以是傳染性的,也可以是非傳染性的,通常將鼠白血病病毒(MuLV)用作模型。
典型的單克隆抗體生產過程包括將中間樣品的pH降低至3.6-3.7的步驟。這種弱酸性條件對許多包膜病毒(包括MuLV)具有很強的滅活作用,因此對減少病毒有重要作用。但是,該過程對變化非常敏感:在pH大于3.8時,失活會明顯減少,在pH小于3.6時會形成聚集體。
病毒滅活過程通常在攪拌槽中進行,在攪拌槽中控制pH,保持時間和溫度。將pH值調整到所需的酸性值后,工藝員會在指定的溫度下將罐中的內容物孵育指定的時間,以實現有效的病毒滅活。之后,將溶液中和,并根據需要進行下一步處理的調整。
在滅活過程中,重要的是批次中的所有材料必須在指定的持續時間內達到目標pH值。否則,某些材料可能會將仍然活躍的RVLP攜帶到下游(殘留),從而損害了所需的病毒減少率。殘留物來源包括:
1、使用不正確或者不清潔的傳輸線
2、滅活前后使用相同的設備
3、可能重新進入工藝流程的飛濺物或氣溶膠的產生
4、容器的死角區域(例如,采樣端口,儀器端口和噴嘴)中存在液體。
生物制藥生產商通過實施雙容器設計減輕了這些風險:在第一個容器中降低過程溶液的pH,并將其內容物轉移到第二個容器中進行孵育。這樣可確保第二個容器中的所有材料都已達到所需要的pH。
這得到企業和監管機構的公認,在包括ICH Q7在內的許多監管指南中都解決了殘留污染病毒清除的風險:“應采取適當的預防措施,以防止病毒從病毒前到病毒后的去除/滅活步驟的潛在病毒污染。” 適當的預防措施一詞值得進一步檢查。殘留物對病毒清除的影響可以使用一個簡單的數學模型來計算。這樣的計算對于定量表征多少殘留物會損害特定步驟(例如低pH保持)中的病毒清除率很有用。基于此類計算,可以評估是否已采取“適當的預防措施”以防止殘留,否則會損害病毒清除率。重要的是要注意,這種計算僅在沒有病毒傳播的情況下才有意義(例如,無宿主細胞的下游操作)。
下面,我們展示一個示例,說明如何在MAb純化過程中將數學計算與低pH滅活步驟的失效模式和效果分析(FMEA)結合使用。如果使用其他類型的化學滅活劑(例如,溶劑/洗滌劑),則可以使用相同的考慮因素來處理殘留。
工藝說明
在典型的下游工藝中,首先通過蛋白A色譜介質結合來捕獲MAb。然后用低pH洗脫緩沖液從該捕獲柱上洗脫MAb。洗脫后,將洗脫液的pH調節至3.6–3.7,然后保持一小時。通過中和溶液的pH來終止低pH滅活步驟,以準備后續的純化步驟,例如離子交換色譜(IEC)。圖1顯示了可用于低pH值病毒滅活步驟的一次性容器和傳統的多次使用容器。

圖1:用于低pH值病毒滅活的設備示例;(上圖)帶有集成攪拌器的一次性袋子系統;(下圖)一個典型的不銹鋼罐,其中顯示了常見的配件,例如入口,出口,套管等。
當使用多用途容器時,蛋白A柱的洗脫液通過靠近容器壁的入口管或J管(圖1中的“浸入管”)小心地輸送到病毒滅活容器中,從而最大程度地減少了泡沫,防止噴濺。在滴定過程中,將容器中的物料連續混合以確保均勻(通常在滅活期間內)。通常的保持時間為一小時后,將低pH值的溶液中和,并準備進行后續純化。在孵育過程中,將監控溫度和pH,以確保有效地滅活病毒。現代技術允許完整的滅活過程在封閉過程中執行,包括所有轉移,監測,混合,取樣和滴定步驟。
為了我們的目的,我們假設一個模型,其中滅活步驟(Vbefore)之前的蛋白A洗脫液體積為400L,低pH滅活步驟(RFlab)的MuLV還原因子為5log。
臨界潛在殘留量計算
基于科學家提出的數學模型。可以計算出可能影響像上述容器那樣在低pH值步驟中失活的潛在殘留物(VCo)的體積:
VCo = 400L÷10 5 =4mL
因此,如果將>4 mL的滅活前溶液轉入滅活后溶液中,則會損害低pH步驟的病毒還原,從而影響藥物產品的安全水平(RVLP/劑量)。如果4mL在槽中某個地方沒有通過低pH處理(例如,如果pH保持在3.8以上),并且沒有轉移“ MAB”溶液的距離更遠,則可能發生這種現象。
失效模式對病毒清除的影響
我們關注的與滅活前和滅活后材料之間的過程分離相關的失靈模式不包括關鍵的病毒失活參數,例如pH,溫度,混合和緩沖液制備。在有效的過程隔離中(與房間隔離相反),所有滅活后的物質均已從非滅活溶液中成功分離出來。接下來是對滅活過程中不同元素的系統評價,以及與這些元素相關的分離失敗的可能性。注意,下面提到的大多數生物處理設備要素在美國機械工程師協會(ASME BPE)的生物處理設備標準中進行了討論。
儲罐的入口管應足夠寬,以使來自蛋白質A捕獲步驟的所有洗脫液都轉移到儲罐中。如果使用狹窄的入口管,則某些洗脫液可能會殘留在該管中(例如,通過毛細作用)。在保持期間或之后,此類物質可能會由于干擾而進入儲罐。還應考慮在噴嘴,進液口(>1000 L的大型容器)或頭法蘭(<2000 L的容器),噴射裝置,汲取管,頂部安裝的攪拌器支架等中滯留流體的可能性。
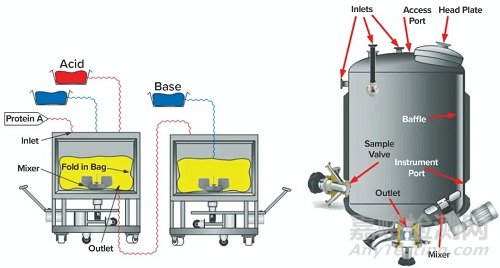
圖2:一次使用和傳統的不銹鋼多次使用容器剖面圖描繪了典型組件,建議特別注意潛在的殘留物。
小型移動式儲罐通常將下部連接到頂部(圖3)。通常,該組件不會浸入水中,因此在該區域可能會發生洗脫液的液體滯留量不會暴露于低pH值的情況。例如,如果焊接邊緣(圖3中標記為“ 6”)不完全光滑,則液體會進入并通過毛細作用保留。在病毒滅活后,在此之前或在O形環凹陷處或O形環凹陷處(圖3中標記為“ 7”)捕獲的任何未經處理的過程材料都可能重新進入過程流,從而危及病毒的安全性。緩解措施可包括確保未經處理的材料不會進入組裝點,將儲罐填充至該點以上,用pH值調節過的材料沖洗組件或重新設計儲罐組件。

圖3 :(左)用于低pH值病毒滅活的小型移動水箱以紅色圓圈顯示了裝配點。(右)上下箱部件之間的組裝詳細信息,突出顯示(1)下法蘭,(2)上法蘭(3)O形圈密封,(4)組裝螺栓,(5)墊圈, (6)每個法蘭和水箱之間的焊接邊緣,以及(7)組裝的O形圈密封件。
出口閥:
完成低pH滅活后,將槽中的物料轉移到下一個下游操作,這通常是色譜步驟。這種轉移通常通過水箱底部的出口閥進行。這種閥門的設計可能對病毒的安全性產生深遠的影響。
圖4左側的閥設計為無袋形結構。攪拌槽時,隔膜上方的容積也將與槽中的物料有效混合。相比之下,在圖4右側的設計示例中,將閥門放置在出口管道上,從而在混合罐和閥門之間產生較小的滯留體積。即使罐中內容物的劇烈混合也不大可能確保與該死腿區域的內容物充分混合。因此,這種袋中的材料可以逃脫滅活。這樣一個口袋的容量很容易達到幾毫升。由于其位置,當罐中的物料被轉移到下一個制造工藝步驟時,這種材料肯定會在中和后向下游移動。
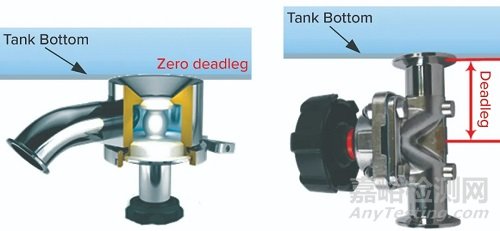
圖4:出口閥設計實例;(左)閥膜片放置在靠近罐腔的位置;(右)閥在水箱和隔膜之間有死角區域。對于后者,停滯的液體有可能逃脫低pH值病毒滅活條件的高風險。
如果無法消除這種凹坑,則一種可能的緩解措施是將調節后的單克隆抗體溶液通過出口再循環,然后通過入口再循環回儲罐。這將消除袋效應,并確保所有MAb溶液都能達到目標酸度。另一個緩解方法是使用在線pH調節,從而確保所有進入儲罐(及其容器)的材料都經過pH調節,并且所有病毒均被滅活。因此,可以使用圖4中所示的兩種出口設計,但是可能需要采取其他措施來減輕滯留形成的風險。
側彼附件:
當使用鋼制儲罐時,生物制藥工藝工程師會選擇其尺寸,以確保最小的頂部空間,從而確保最小的非浸沒表面積。一定量的水可以坐在水箱的上側壁,蓋子,噴球或液體表面上方的其他區域,并且該物質可以逃脫病毒的滅活作用。如果此類材料在低pH處理后重新進入過程流,則未滅活的病毒將重新引入溶液中。根據儲罐設計的不同,此體積可能足夠大以損害病毒清除能力。使用工作量較小的大型水箱會出現最壞的情況。因此,應適當考慮此故障模式。
溫度和pH探針:
正確的溫度和pH值對于確保有效的病毒滅活都很重要。因此,在孵育過程中會連續測量兩個參數。通常,兩個探針在孵育過程中都永久安裝,并保持與過程材料接觸。不應有不會達到目標pH和/或溫度的相關口袋。圖5a和5b描繪了不同的熱套管設計。應當仔細考慮容器壁和法蘭之間的距離,以及套管和放置套管的直徑。我們必須確保所有液體混合正確。注意,類似的考慮也適用于所有安裝件,即使未使用的安裝件也是如此。

圖5a:使用標準法蘭設計(左)或焊接設計(右)的不銹鋼罐中熱套管的典型側壁安裝選項,可消除潛在的死角區域。

圖5b:使用NA Connect接頭(NovAseptic)進行混合的儀器端口,沒有液體區域停滯。如果設計或安裝不正確,則其他設計也會產生死角區域。
一種不同的方法是在t=0時使用相同的pH探針,然后在孵育期結束時驗證正確的pH。在這種情況下,操作人員應確保在培養結束時,不會將電極表面的任何物質(從t=0開始測量)重新引入水箱。
這些示例用于說明有關側壁附件(例如溫度或pH傳感器)的殘留風險的一些相關考慮因素。它們只是例子。每臺設備均需進行詳細檢查。盡管熱套管和其他端口對于正常操作是必需的,但此類元件還具有通過產生死角區域而損害病毒安全性的潛力。
人員:
操作員經常執行手動物料轉移和pH調節。因此,預滅活材料受到相關污染(例如手套污染),然后在滅活后與工藝流接觸,因此構成了一種故障模式,該模式可能使某些材料無法通過低pH處理。手套被足夠的材料污染以致無法隔離的可能性很小;但是,可以通過確保在滅活前和滅活后接觸(“工作服”)之間更換手套,或通過使用無菌連接器(而非法蘭連接器)來最大程度地減少接觸,來輕松解決這種故障模式。
氣霧劑:
如果在低pH調節之前產生氣霧劑,那么在整個病毒滅活期間,此類飛沫可能會在制造工廠中持續存在。中和過程溶液后,氣溶膠滴可能重新進入過程流,并將潛在的未滅活病毒帶入下游過程。然而,氣溶膠攜帶的體積太低,以至于對低pH步驟的病毒滅活效果沒有任何實際影響。因此,在這種情況下,pH滅活后此類氣霧劑進入后調節罐應無實際問題。
正確的設計是關鍵
在兩個階段的評估中,我們使用了數學工具來確定病毒滅活過程對殘留物的敏感程度。然后,我們在第二階段使用該模型的結果,使用FMEA來確定可能導致與病毒安全性相關的工藝材料殘留的條件。我們以前使用相同的模型來研究在制造過程的多個階段使用單個CIP撬塊期間的殘留。
因此,我們使用數學模型將注意力集中在那些對低pH病毒滅活有最大影響的失效模式上。我們的模型可以區分哪些風險是實際的,哪些需要考慮,哪些沒有實際的重要性。這些知識可以指導設備和過程設計,以充分減輕遺留風險。
得出的結論始終取決于為模型研究選擇的特定條件-在這種情況下,對400 L的體積進行了5對數滅活。使用我們的數學模型,可以輕松解決其他條件。例如,如果已證明7對數滅活,那么將應用更小的殘留量,“口袋形成”的重要性(例如,一個例子)大大增加,并且(另一個例子)可能需要緩解以防止氣溶膠生成。在整個純化過程中具有過量的累積清除率可補償本文所述單個步驟的輕微(潛在)病毒還原失敗。這些其他步驟可能對結轉敏感的程度必須單獨評估。
我們的數學模型可以成為評估病毒隔離的易于理解的工具。它可以為數據驅動的設施,過程和設備設計評估提供框架。或者它可以用來指導流程步驟執行以消除故障模式。通過其簡單性,該模型可以幫助確保將努力放在最大效果的地方,從而在設備,設施和過程設計期間支持成本效益。
鼓勵員工參與此類討論,除了使所有參與者對關鍵問題和不關鍵問題有實際的了解之外,還可以有助于更好地了解謹慎的隔離做法的必要性。保持有效的隔離不僅取決于設施設計和程序,還取決于對隔離的關鍵性的徹底理解和對故障模式的理解,如本文所述。
請注意,我們僅解決了pH滅活步驟本身。此處未考慮進出其他制造步驟的進出(例如,預捕獲材料的進入或病毒過濾后可能進入過程的材料的釋放)。我們的示例僅涉及pH值步驟,但是原理可以輕松調整,并應用于其他類型的純化步驟,甚至可以評估在同一設施內執行的一系列步驟的分離。重要的是要整體考慮生物制造過程,同時分別評估每個步驟。例如,pH失活過程中產生的氣溶膠對于特定步驟可能不是問題,但是如果它們進入更下游的過程(例如,病毒過濾后),它們可能會嚴重危害病毒清除。
可以通過不同的措施來減輕本文所述的潛在設計缺陷的風險,例如對儲罐或附件設計進行更改,在轉移至儲罐的過程中在線調節pH值,使用如上所述的兩容器配置,甚至進行連續處理。但是,也應仔細檢查此類過程的可能故障模式,并進行如上所述的類似分析。一些故障模式將消失,一些故障模式將保留,并可能出現新的故障模式。
顯而易見的是,所有設備元件的正確設計對于防止殘留和導致無法將未處理材料與處理過的處理材料隔離是至關重要的。符合適當的設計標準(例如ASME BPE)將使您朝著這個目標走很長的路。但是,設計標準沒有包含用于確定給定殘留量的臨界度的定量工具。
所有設施和程序都互不相同,我們在此介紹的要素必須適應個別設施中的特定條件。但是,一般原理保持不變,并且使用一種系統化的方法(如我們目前提出的方法)可以幫助生物制藥開發商在下游過程中的低pH滅活步驟中實現足夠的分離。
文章來源:
1、ICH Q5A(R1). Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal Origin. US Fed. Reg. 63(185) 1998: 51074; https://database.ich.org/sites/default/files/Q5A%28R1%29%20Guideline_0.pdf.
2、ICH Q7. Good Manufacturing Practice Guidance for Active Pharmaceutical Ingredients. US Fed Reg. 66(186) 2001: 49028-49029; https://database.ich.org/sites/default/files/Q7%20Guideline.pdf.

來源:藥時空


