養(yǎng)在器皿里的細胞,怎么知道它到底“長”了沒和“長”得怎么樣?
細胞增殖測定是解決辦法。今天,我們來盤點一下常用方法有哪些,該如何選擇。
1 細胞增殖測定方法匯總
細胞增殖測定方法可以分為三類:直接計數(shù)、間接檢測、直接檢測。
一、 對細胞直接計數(shù)
顧名思義,就是“數(shù)細胞”,簡單粗暴。
通過血球計數(shù)板或自動化細胞計數(shù)儀,直接對細胞懸液中的細胞進行計數(shù)。
直接計數(shù)的優(yōu)點是直觀,所見即所得。但血球計數(shù)板效率較低,且易受人為判斷誤差影響;自動計數(shù)儀效率高,購置和使用成本也較高。
圖源:https://zh.wikipedia.org/zh-cn
二、 檢測“代謝”產(chǎn)物間接判斷
理論上,細胞越活躍,代謝和增殖就越旺盛。不去數(shù)細胞,而是測定它們的“代謝活力”,可以以此來評估細胞增殖能力。測定的指標通常包括線粒體酶的活性或ATP含量。
基于代謝活性的方法是目前實驗室最常用的細胞增殖測定手段之一 。例如測活細胞內(nèi)線粒體脫氫酶等代謝酶的活性 。
1 MTT法
MTT是一種黃色染料,能被活細胞線粒體中的脫氫酶還原成紫色的甲臜(Formazan)結(jié)晶,溶解后測吸光度。細胞增殖活力越強,吸光度越高。
但甲臜結(jié)晶不溶于水,反應結(jié)束后需額外加入DMSO輔助溶解,并且試劑本身對細胞有一定損傷,可能會影響實驗結(jié)果的準確性。
2 CCK-8法
它是MTT法的“升級版”,用的是WST-8試劑,生成的產(chǎn)物是水溶性的,省去了溶解步驟,“加樣-孵育-測量”就行。
現(xiàn)在大多數(shù)實驗室已經(jīng)用CCK-8取代了MTT。
圖源:https://www.drugdiscoverynews.com/top-instrument-considerations-for-an-mtt-assay-15803
3 基于ATP含量檢測
ATP作為細胞的能量單位,其濃度與活細胞數(shù)量密切相關(guān)。
利用熒光素酶催化熒光素與ATP反應產(chǎn)生光信號,發(fā)光強度與細胞內(nèi)的ATP濃度呈正比,而ATP濃度又與活
細胞數(shù)量存在正相關(guān)的線性關(guān)系。
因此,產(chǎn)生的光信號可以間接反映活細胞數(shù)量,用于評估細胞增殖狀態(tài)。
三、 直接檢測細胞增殖標志物
顧名思義,這類方法通過直接測量細胞分裂過程中發(fā)生的特定分子事件(如DNA合成)來評估細胞增殖。
1 ³H-胸苷摻入法
老派但經(jīng)典。將放射性同位素標記的胸苷(³H-thymidine)加入培養(yǎng)體系,它會隨細胞合成DNA時一起摻入進去。
之后,檢測培養(yǎng)體系的放射性強度。信號越強,說明DNA合成越活躍。這個方法的問題是不安全——有輻射。操作流程較復雜,廢棄物處理也麻煩,所以現(xiàn)在也逐漸被淘汰了。
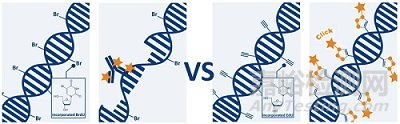
2 BrdU/EdU法
這是³H-胸苷的基礎(chǔ)上,衍生出來的非放射性替代方案。BrdU和EdU都是人工合成的胸腺嘧啶類似物。在細胞的DNA復制過程中(S期),會代替天然的胸腺嘧啶摻入到新合成的DNA鏈中。
不同的是,使用BrdU法檢測時,需要對細胞進行DNA變性處理,破壞雙鏈結(jié)構(gòu)以暴露BrdU,抗體才能有效結(jié)合BrdU;而EdU分子大小遠小于BrdU,它利用“點擊化學”(Click Chemistry)反應,整個反應過程無需DNA變性,因此實驗過程更簡單,對細胞損傷更小。
這兩種方法后續(xù)通常會結(jié)合免疫熒光或流式細胞術(shù)進行分析,可以精確知道有多少細胞正在復制DNA,非常適合細胞周期分析。
圖源:https://www.baseclick.eu/product/edu-cell-proliferation-assay-for-flow-cytometry/
3 活細胞熒光標記/染料稀釋法
以CFSE為例,這是一種可穿透細胞膜的熒光染料,能在活細胞內(nèi)均勻標記胞內(nèi)蛋白。每當細胞分裂一次,熒光染料被平均分配給兩個子代細胞,熒光強度就減半。
借助流式細胞術(shù),我們就可以分析熒光強度的變化,就能追溯一個細胞經(jīng)歷了多少次分裂。
這種方法不僅能告訴你增殖了多少,還能看到不同子代群體的分布。因此,當我們需要追蹤單個活細胞在一段時間內(nèi)的分裂代數(shù)時,這會是一個很好的選擇。
老司機整理了一張表格,將常用的幾種檢測方法做了對比:
3 如何選合適的細胞增殖方法
測細胞增殖,沒有一勞永逸的方法,沒有“最好”,只有“最合適”,我們要結(jié)合具體的實驗目的來選擇。
舉個例子,假如你在做藥物篩選,需要在短時間內(nèi)快速測試數(shù)種化合物對細胞的影響,那像MTT、CCK-8或ATP發(fā)光法這類操作簡便、適用96孔板高通量檢測的方法就是首選。
只需準備好細胞,然后加試劑、測吸光度,一天就能測完數(shù)百次分析,效率非常高,這樣就能幫助我們快速鎖定有潛力的候選化合物,非常適合初篩階段。
但如果你關(guān)心的是“細胞到底有沒有增殖”,比如研究某個基因敲除是否會導致細胞周期阻滯,那就不能只看代謝活性了。
這時可以選EdU摻入法,它只在S期被摻入到新合成的DNA中,可以為S期細胞的量化提供更準確的數(shù)據(jù)。
再比如,你想追蹤免疫T細胞在抗原刺激下的擴增過程,那就不僅要看細胞有沒有增殖,還需要知道它分裂了幾代。這時可以選擇CFSE稀釋法。
CFSE能均勻標記細胞蛋白,每次細胞分裂后熒光強度減半,通過觀察熒光信號,就能清晰追蹤單個細胞的分裂過程。
4 細胞增殖測定的合適時機
無論用哪種方法測細胞增殖,如果測的時機不對,到最后可能是白忙活一場。因為細胞的生長并不是勻速的。
在剛接種后,它們需要適應新環(huán)境,這段時期稱為“停滯期”,細胞基本不怎么分裂;細胞適應后就進入“對數(shù)生長期”,這時候細胞活力最強,分裂最旺盛,倍增一次的時間是穩(wěn)定的;到了培養(yǎng)皿快被填滿、營養(yǎng)耗盡、代謝廢物堆積時,細胞就進入“平臺期”,這時候的細胞增殖幾乎停滯。
檢測細胞增殖,需要在對數(shù)期內(nèi)進行。在停滯期或平臺期進行實驗和檢測增殖,數(shù)據(jù)不能準確反映細胞的真實增殖能力。
圖源:https://www.huankai.com/show/46953.html
如何確定細胞是否處于指數(shù)期?靠預實驗+繪制細胞倍增曲線。
在細胞接種后的不同時間點(比如0、24、48、72、96 h)取樣,計算細胞數(shù)量,然后畫出細胞數(shù)量隨時間變化的曲線——即細胞生長曲線。從這條曲線上,我們就能清楚地看到對數(shù)期的區(qū)間和所對應的時間節(jié)點。
假如,細胞接種后從24 h開始進入對數(shù)生長期,至96 h長滿,那實驗設(shè)計時,細胞增殖能力的測定時間點就應該取在這兩者之間,例如24、48、72 h。
無論選哪種檢測方法,都需要記住:先做預實驗,摸清細胞的生長曲線,在對數(shù)期內(nèi)根據(jù)實驗目的選一個合適的方法來測量,才能拿到真實可靠的實驗數(shù)據(jù)。