今日頭條
禮邦腎病創新藥獲孤兒藥資格。禮邦醫藥創新藥物AP303獲FDA授予孤兒藥資格,用于治療常染色體顯性多囊腎病(ADPKD)。這是最常見的單基因腎病,也是全球導致成人終末期腎病的主要原因之一。在臨床前ADPKD小鼠模型研究中,AP303已顯示出提高腎臟存活率的潛力。目前該新藥已完成用于健康受試者的首次人體試驗,即將開展針對ADPKD的Ⅱ期臨床研究。
國內藥訊
1.AZ降血壓新藥啟動Ⅲ期臨床。阿斯利康新型醛固酮合成酶抑制劑(ASI)baxdrostat在中國登記啟動一項國際(含中國)Ⅲ期臨床,擬評估用于治療接受兩種或兩種以上藥物治療且未受控制的亞洲高血壓受試者(包括難治性高血壓受試者)的有效性和安全性。該項試驗中國部分由上海交通大學醫學院附屬瑞金醫院王繼光博士擔任主要研究者。去年1月,阿斯利康通過收購CinCor Pharma獲得了這款新藥。
2.信達兩款新藥擬納入突破性治療品種。信達生物CTLA-4單抗IBI310及PD-1抑制劑信迪利單抗兩款產品獲CDE擬納入突破性治療品種,適應癥為:“IBI310聯合信迪利單抗用于可切除的高微衛星不穩定性(MSI-H)或錯配修復基因缺陷型(dMMR)結腸癌的新輔助治療”。值得一提的是,該組合療法針對上述適應癥剛啟動一項III期臨床(Neoshot),目前已完成首例受試者給藥。
3.海思科鎮痛新藥獲批新IND。海思科1類化藥HSK16149膠囊獲國家藥監局臨床試驗默示許可,擬開發治療中樞神經病理性疼痛。HSK16149是一種電壓門控鈣離子通道類新型鎮痛藥,可與鈣離子通道α2δ亞受體結合,具備高靶點選擇性、強效鎮痛、長效鎮痛、中樞副作用小等特點。目前該新藥用于治療糖尿病周圍神經痛、以及帶狀皰疹后遺神經痛的兩個NDA申請均在接受CDE監管審查。
4.三迭紀又一款新藥獲批IND。三迭紀2.2類化藥D23(布地奈德遲釋片)獲國家藥監局臨床許可,擬開發用于降低有快速疾病進展風險的原發性免疫球蛋白A腎病(IgAN)成人患者的蛋白尿,一般為尿蛋白/肌酐比值(UPCR)≥1.5g/g。這是一款改良型新藥,采用三迭紀的熔融擠出沉積工藝,并基于3D微結構調釋平臺開發。目前,該公司已有5款3D打印藥物獲批臨床。
5.科弈雙靶點CAR-T獲批新IND。科弈藥業1類生物制品“KQ-2003自體嵌合抗原受體T細胞注射液”獲國家藥監局臨床試驗默示許可,擬開發用于治療復發/難治性POEMS綜合征。KQ-2003能同時靶向B細胞成熟抗原(BCMA)和CD19兩個治療靶點。去年8月,該新藥已獲批開展Ⅰ期臨床,評估用于四線及以上治療復發/難治性多發性骨髓瘤(MM)的安全性與初步療效。
國際藥訊
1.AZ罕見病新藥獲FDA批準上市。阿斯利康“first-in-class”口服補體因子D抑制劑Voydeya(danicopan)獲FDA批準上市,聯合標準療法補體因子C5抑制劑Ultomiris(ravulizumab)或Soliris(eculizumab)輔助治療陣發性睡眠性血紅蛋白尿癥(PNH)成人患者的血管外溶血(EVH)狀況。在III期ALPHA臨床中,Voydeya聯合治療與標準療法相比,患者第12周時血紅蛋白水平的最小二乘均值(LSM)相對于基線的變化顯著增加(2.94 g/dL vs 0.50 g/dL,p<0.0001)。
2.衛材/渤健Aβ抗體在美報sBLA。衛材/渤健Aβ抗體侖卡奈單抗(Lecanemab,Leqembi)靜脈注射(IV)劑型向FDA遞交補充上市申請(sBLA),用于維持治療早期阿爾茨海默病(AD)患者。在Clarity AD(Study 301)研究中,lecanemab較安慰劑使患者的臨床癡呆癥評分總表(CDR-SB)分數下降了27%;輕度認知障礙-日常生活能力量表評分(ADCSMCI-ADL)也下降了37%。此外,侖卡奈單抗皮下注射(SC)劑型也即將提交用于維持治療AD的BLA申請。
3.羅氏gMG新藥達Ⅲ期主要終點。羅氏宣布其IL-6R抗體Enspryng治療全身型重癥肌無力(gMG)的Ⅲ期臨床LUMINSCE達到主要終點,但臨床獲益程度未達到預期。此外,藥物安全性與Enspryng在治療視神經脊髓炎譜系障礙(NMOSD)中的安全性一致。詳細結果將公布于4月15日在科羅拉多州丹佛市舉行的美國神經病學學會(AAN)2024年年會上。NMOSD是該藥的第一適應癥。
4.癌癥TCR-T見刊《柳葉刀》。Adaptimmune公司靶向MAGE-A4的TCR-T療法afami-cel治療滑膜肉瘤和粘液樣圓細胞脂肪肉瘤的Ⅱ期臨床SPEARHEAD-1積極結果發表于《柳葉刀》上。中位隨訪為32.6個月時,滑膜肉瘤患者的ORR為39%,粘液樣圓細胞脂肪肉瘤患者的ORR為25%。此前,FDA已授予其治療軟組織肉瘤的孤兒藥資格和治療滑膜肉瘤的再生醫學先進療法認定,并將其針對晚期滑膜肉瘤的上市申請納入優先審評。
5.長效GLP-2激動劑Ⅱ期臨床積極。Ironwood公司GLP-2激動劑apraglutide治療類固醇難治性胃腸道急性移植物抗宿主病(SR GI aGVHD)患者的Ⅱ期探索性研究STARGAZE結果積極。患者在標準治療的基礎上接受一周一次的apraglutide治療,大多數患者在第28天實現下消化道應答,療效維持長達56天,且藥物安全性和耐受性良好。詳細結果將在醫學大會上發布。
6.自免病CAR-T硬化癥研究見刊。Kyverna公司靶向CD19的自體CAR-T產品KYV-101在《Med》雜志上發表其用于治療進展期多發性硬化癥(MS)的臨床研究積極數據。KYV-101旨在深度誘導血液循環和組織,實現B細胞完全耗竭,對B細胞驅動的自身免疫性疾病具有治療潛力。研究結果顯示,藥物總體安全性可控,未觀察到早期神經毒性的臨床癥狀。今年1月,該新藥已獲得FDA授予治療MS的快速通道資格。
醫藥熱點
1.呂凌任徐州醫科大學附屬醫院黨委書記。3月27日下午,徐州醫科大學附屬醫院召開干部大會,宣布徐州醫科大學黨委關于醫院干部任免決定:呂凌同志任附屬醫院黨委書記,王遠清同志任附屬醫院黨委副書記,王人顥同志因年齡原因不再擔任附屬醫院黨委書記職務。公開信息顯示,呂凌,主任醫師,教授,博士生導師,專業主攻方向為:移植免疫與再生修復的轉化研究。此前,呂凌任徐州醫科大學黨委常委、副校長。
2.FDA緊急一級召回一款心臟泵。當地時間3月30日,FDA要求強生子公司Abiomed召回旗下Impella系列介入心臟泵,召回等級為最嚴重的一級召回。據悉,心臟泵能夠在醫療過程中或嚴重心臟病發作后對心室中的血液泵送提供短期支持。FDA表示,召回這款心臟泵的原因是,其泵導管在手術過程中可能會刺穿心臟左心室壁并導致嚴重的不良后果,包括左心室穿孔、離壁破裂、高血壓供血不足以及死亡。數據顯示,該產品已導致129人重傷,其中49人死亡。
3.倫敦兩家生育中心凍卵爆出丑聞。據英國《每日郵報》3月30日報道,因在冷凍過程中出現錯誤導致大量卵子無法存活,英國人工受精與胚胎學管理局(HFEA)已吊銷霍默頓生育中心的運營許可,并對其存在的問題進行調查。霍默頓生育中心還因涉嫌瞞報事故正接受英國警方的調查。據悉,卵子冷凍是試管嬰兒手術的重要組成部分,該手術在英國平均價格約為4000英鎊,卵子后續的存儲費用平均每年在15至350英鎊之間。
評審動態
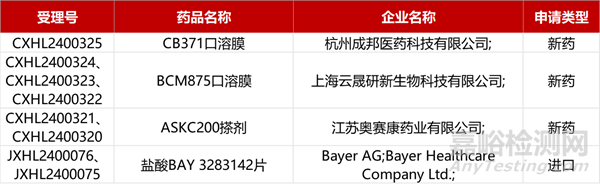
1. CDE新藥受理情況(04月01日)
2. FDA新藥獲批情況(北美03月29日)