制藥企業進行驗證活動時——可能會出現測試結果與驗證目標不一致的情況,對于同一個不一致,不同的原因處理方式亦不同。對偏差進行分類管理,以不同的方法和流程區分對待,一方面能達到降低質量風險的目的,另一方面企業的偏差管理體系會更加系統、科學、高效。
根據各國GMP相關法規和指南的要求,制藥企業應當有計劃地開展驗證活動,以保證整個生產過程受控。而驗證過程中會不可避免地出現與驗證目標不一致的情況。對于這種“不一致”,只有基于一套完善的偏差管理體系來支撐,才能真正達到準確處理與風險控制的效果。
驗證過程中的偏差發生
偏差系指偏離已批準的程序(指導文件)或標準的任何情況(引自ICH Q7,原文為:Deviation - Departure from an approved instruction or established standard.)。因此偏差發生的前提是已經預先定義了規則,偏差管理的基礎是有效的,足以控制生產過程和藥品質量的程序(指導文件)或標準。
驗證活動是按照被批準的驗證方案來實施的,在這份驗證方案中,必須清楚地界定關鍵系統屬性和參數,以及相關的可接受標準。在驗證執行過程中,任何與可接受標準的偏離,都屬于偏差的范疇,如未按照方案執行,出現了不符合既定可接受標準的結果等。對于出現的偏差,必須真實地記錄在報告中,并根據偏差管理的程序作出對應的處理,最終在所有的偏差已被關閉或者其影響可接受時給出驗證成功的結論。
驗證過程中的偏差分類
我們應該注意到,驗證本身即是證明預先提出的程序或標準是否可以被確認的一個過程,即使導出了與預期不一致的結果,也不能說明驗證對象(設施設備、儀器或系統)會對產品質量等造成影響(無論影響大小)。驗證過程本身也是一個不斷完善的過程,是“提出標準或標準程序——實施驗證或確認——得出結論——重新審視標準——驗證對象修改或預期標準調整——再次驗證或確認”的一個螺旋前進或上升的過程。
具體來說,驗證是證明任何操作規程(或方法)、生產工藝或系統能夠達到預期結果的一系列活動。即驗證是在證明方法或者程序是適用的,是通過先設立一個理論上的標準,在經由一系列驗證活動,最終建立或確定標準的過程。這個過程區別于正常生產的狀態,正常生產中的標準是確定的或者是已被驗證的。而驗證過程中的“標準”是一個預設的標準,是正常生產標準的初始值、理論值或經驗值,經過驗證之后,這個“標準”才被最終確定為正常生產的標準。
在驗證過程中產生的偏差,一部分是對已確定標準的偏離,一部分是對正在建立的標準的偏離。已確定的標準,包括但不限于已批準的操作規程、驗證所用儀器設備、對物料的標準、對環境的要求等。正在建立的標準,比如設備本身未經過確認的屬性(已經過確認的屬性為已確定的標準)、設備運行的方法與能力、清潔設備的方法等。對這兩種不同標準的偏離,將驗證過程中出現的偏差分為了兩類:常規偏差和驗證偏差。
換言之,常規偏差是對已確定標準的偏離,除了驗證過程中的某些情況,主要發生在正常生產過程中,產生于已驗證的對象,如清晰明確的生產工藝、物料平衡限度、質量標準、檢驗方法、操作規程等。
盡管任何企業都無可避免地在生產過程中產生偏差,但這類偏差理論上是不應該發生的,制藥企業應通過完善的組織機構、合理的文件系統和充分的人員培訓來最大限度地預防偏差的發生。正如《藥品生產質量管理規范(2010年修訂)》中的要求:“各部門負責人應確保所有人員正確執行生產工藝、質量標準、檢驗方法和操作規程,防止偏差的產生。”而驗證時發生的常規偏差,GMP附錄《確認與驗證》中亦有明確的要求:“企業應當在報告中對確認與驗證過程中出現的偏差進行評估,必要時進行徹底調查,并采取相應的糾正措施和預防措施”。
對于驗證偏差,是對不確定標準的偏離或不符合。比如設備在進行安裝確認(IQ)時,PID圖紙與實際情況有差異,此時的圖紙是設計的“標準”,不是經過確定的最終標準,因此這種差異是對不確定標準的差異。又如潔凈區的更衣程序,驗證過程中發現當前的程序不滿足微生物限度的要求,由于此時的程序是不確定的,因此造成的不符合要求的結果也屬于對不確定標準的偏離(這種不確定標準是雙向的,即驗證對象的不確定和接受標準的不確定)。GMP附錄《確認與驗證》中這樣描述這類偏差:“當驗證結果不符合預先設定的可接受標準時,應當進行記錄并分析原因。企業如對原先設定的可接受標準進行調整,需進行科學評估,得出最終的驗證結論。”該條款不僅給出了驗證偏差的范圍,也給出了應采取的行動。
對比GMP中這兩類偏差的描述,可見對于常規偏差和驗證偏差的管理要求不同,其處理方式也是不同的。
驗證偏差與常規偏差的區別
發生的原因不同
驗證偏差是由于驗證對象本身的不確定因素造成的,因為驗證對象未經過確認或驗證,不可避免地會出現不符合既定的驗證目標值的情況。比如貼標機運行能力的驗證,在URS中,貼標機的運行能力需求為不低于250?瓶/min,設備廠家提供的設備說明為300?瓶/min,于是方案中的可接受標準設計為300?瓶/min,而驗證時只能達到280?瓶/min,這種偏離的原因顯然是方案中的標準是廠商設定的、共性的、理想狀態下的目標值,而驗證的結果才能真實地反應出這臺設備的實際能力。
常規偏差發生的原因很多,更加復雜,并且往往需要調查才能找出根本原因。驗證過程中發生的常規偏差,可能是用于驗證的方案不適用,比如使用了錯誤版本的方案;可能是測試所用的儀器不符合條件,比如超出了校準有效期或者在有效期內但是出現了超出計量范圍的異常值;可能是物料不滿足要求,比如使用了錯誤批號的物料或者未被放行的物料;可能是人員操作不規范,比如未按照要求取樣造成樣品受到污染等。這些引發偏差的原因或簡單或復雜,或單一或多重,歸根結底都是可以規避的,都是“可以不發生”的。
處理方式不同
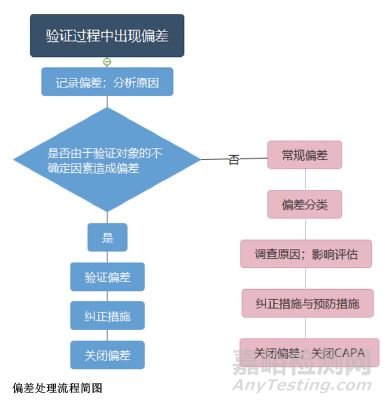
驗證偏差需要記錄和解釋,必要時采取措施達到一致,如通過科學評估對原先設定的可接受標準進行調整,或者通過調整驗證對象使兩者一致。比如在“發生的原因不同”一節中貼標機運行能力驗證的例子,發現運行能力達不到目標值,先記錄偏差,再分析原因是設備本身的屬性達不到驗證目標,需要采取的行動是首先評估280?瓶/min是可以滿足車間對生產能力要求的,因此將驗證方案中的300?瓶/min的標準重新定義為280?瓶/min。此時的280?瓶/min是經過驗證的標準,當設備投入生產后再出現達不到生產能力的情況時,該偏差便屬于常規偏差,是偏離了已確定標準的偏差,處理方式需按照常規偏差的管理程序進行。
常規偏差首先要對其影響性做出初步判斷,根據其對質量的影響進行分類,如歸為關鍵偏差、中等偏差或是微小偏差。對于微小偏差,比如在使用之前發現倉庫發送了錯誤的物料,僅需要記錄和解釋,并且及時更換物料修正錯誤。對于中等偏差和關鍵偏差,應調查其發生的根本原因,再評估偏差造成的影響,并建立糾正和預防措施(CAPA),批準后完成糾正行動,最后完成偏差報告。
對于常規偏差的處理,需要一套完整的偏差管理體系來支撐,對不同分類的偏差采取對應的處理流程。例如,水系統進行性能確認(PQ)第一階段時發現某用水點微生物超標,由于第一階段的水尚未用于生產,因此不需要執行生產產品相關的緊急措施;由于微生物超標會影響未來產品質量,因此該偏差歸類為關鍵偏差;此時需成立偏差調查小組進行根本原因的調查,并且評估偏差的影響,調查原因和評估影響可采用質量風險管理的方法,利用風險分析工具(如魚骨圖、失效模式影響分析(FMEA)等)得出結論。基于結論,需采取糾正措施來消除偏差的影響,并采取預防措施來避免相同的偏差再次發生以及執行后續的跟蹤程序等。
不同類別的偏差處理流程如上圖所示。
發生的概率不同
對于任何全新的驗證對象,驗證偏差為獨立事件,只會單次出現,因此驗證偏差的處理不需要預防措施。
常規偏差是基于某些原因發生了不該出現的偏離,有可能會再次出現,需在影響評估時分析其發生的可能性,并需要通過預防措施來降低其發生的可能性,從而降低風險,達到風險控制的目的。
關于驗證過程中出現的驗證偏差和常規偏差,下面將會用兩個實例來進行具體分析。
偏差實例分析
實例一
某設備用戶需求(URS)中要求其溫度精度不大于0.5℃,根據廠家文件描述,該設備可控制精度為0.1℃,因此驗證方案中要求其溫度精度不大于0.1℃,驗證時發現該設備只能達到0.2℃的精度。
首先記錄偏差,并分析發生偏差的原因。
如果出現偏差的原因是這臺設備本身達不到驗證目標,該偏差即屬于驗證偏差,應按照驗證偏差的處理方式去處理。此時應采取糾正措施,或者升級驗證方案,或者改變設備硬件,最終需使兩者一致,進而關閉偏差,完成整個驗證過程。
如果出現偏差的原因是溫度探頭損壞,而又因為超出校準時間所以沒有被發現,導致驗證結果不準確,即設備實際是可滿足方案中的精度要求,但測試結果不滿足要求,該偏差即屬于常規偏差。此時需對偏差進行分類,再執行對應的流程。糾正措施是維修并立刻重新校準溫度探頭,并且重新驗證;預防措施是對計量管理部門提出提前校準的控制要求,包括升級標準操作規程(SOP)、使用軟件定期提醒等。
實例二
進行烘箱或滅菌柜的滿載熱分布時,出現溫度分布不均勻的情況。
首先記錄偏差,查找原因。如發現是由于布點時人員操作不規范,探頭直接接觸到了腔體金屬部分,導致導熱異常,屬于常規偏差,處理方式首先進行影響評估,再現場糾正,重新擺放抬頭,使之只能接觸裝載物而不接觸金屬腔體,最后提出預防措施,例如對探頭擺放進行更為標準化的培訓等等。
如果造成偏差的原因是滿載時放置的物料太多或者擺放方式不合理,即是由于裝載量或裝載方式的不確定引起的,屬于驗證偏差。糾正措施為更改驗證方案,使用新的裝載量或裝載方式重新進行熱分布驗證。重新驗證時或許依然不能達到要求,就需要多次調整多次驗證最終確定其裝載量與裝載方式使其溫度分布均勻,才能完成此次驗證。
經過驗證的裝載量和裝載方式是已確定的標準,如果設備使用一年后進行再驗證時發現滿載熱分布不均勻,此時的偏差為常規偏差,需按照常規偏差的處理方式進行調查、風險分析、糾正預防措施等。
實例對比結論
常規偏差產生于一個已經合規的系統或設備,理論上這類偏差是不應該發生的,應評估偏差對人員安全、產品、環境、質量體系等的影響,并基于這些影響進行糾正措施(CA)和預防措施(PA),即需要現場第一時間的糾正和長遠的預防。其目的在于減少同類偏差發生的概率,降低質量風險。
驗證偏差產生于一個未經過驗證的系統或設備,這類偏差的處理通常只是陳述事實,并且進行糾正,不需要預防。其目的是如何從偏差狀態中恢復,以繼續驗證的實施。如果對于驗證偏差,仍然規定需要實施預防措施,則會占用大量資源,甚至得出不可能完成的行動項。
比如在上文中的“實例二”,裝載方式問題,基于該設備是首次引進的新設備,URS只對腔體體積做了要求,且設備滿足這一體積要求。如果在下次類似設備驗證中保證裝載方式不發生產生偏差,則需要的預防措施為:在下次采購前,必須列出該腔體一次使用時所有需要裝載的產品或工器具數量、大小、形狀,且將上述物品全部在設備制造前就送至設備廠家,由廠家在設計確認(DQ)時就擬定具體的裝載方式,且對設備進行非標制造。很明顯,上述預防措施幾乎是不現實,定制化非標設備的價格也不是標準設備所能比擬的,因此雖然理論上行得通,但需要花費大量時間、人力和費用,并不合適,也沒有效率。
總結
驗證過程中產生的偏差,一部分屬于驗證偏差,一部分屬于常規偏差。制藥企業應當建立完善的偏差管理體系,以區別處理這兩類偏差,既能最科學、經濟地達到驗證目的,又能降低質量風險,實現將風險控制在可接受的程度的目標。
參考文獻
[1] ICH Q7,Good Manufacturing Practice Guide for Active Pharmaceutical Ingredients,2000.11.
[2] EU Legislation–EudraLex,Volume 4-Guidelines for good manufacturing practices for medicinal products for human and veterinary use,2015.03.
[3] EU Legislation–EudraLex,Volume 4-Guidelines for good manufacturing practices for medicinal products for human and veterinary use,Annex 15 Qualification and Validation,2015.10.
[3] 國家食品藥品監督管理總局,藥品生產質量管理規范(2010年修訂),2011.03.
[4] 國家食品藥品監督管理總局,藥品生產質量管理規范(2010年修訂),附錄,確認與驗證,2015.12.
[5] 國家食品藥品監督管理局藥品認證管理中心,藥品GMP指南,質量管理體系,2011.08.
[6] 識林網站,IPEM講義,變更和偏差管理以及CAPA,2018.08,http://lib.shilinx.com.