摘要
系統性回顧分析 2005—2021 年中藥有效成分新藥(new Chinese herbal active ingredient drugs,NCHAIDs)的臨床試驗申請、上市申請和臨床試驗登記情況,結果顯示:(1)2005—2021 年申請臨床試驗的 39 個 NCHAIDs 中,19 個品種獲批,批準率為 48.7%,其中 16 個品種已進行臨床試驗登記。2005—2021 年申請生產的 5 個 NCHAIDs 中,有 1 個獲得批準。(2)16 個已完成臨床試驗登記新藥的平均臨床試驗所用時間為 7 年,有 1 個品種完成了 II 期臨床試驗,5 個品種完成了 I 期臨床試驗。(3)NCHAIDs 的適應證相對集中在神經精神、心血管、腫瘤等;對于臨床定位與藥材功能主治相關性較好的NCHAIDs,臨床試驗申請獲得批準的幾率相對較高;有效成分的結構類型較多,其中黃酮、皂苷、內酯等的比例相對較高。建議加強 NCHAIDs 的成藥性研究,控制研發風險;加強 NCHAIDs 的基礎研究;關注 NCHAIDs 的藥動學特性;注重知識產權保護;關注藥材資源及制造成本等問題,為今后 NCHAIDs 的研發提供有益借鑒。
中藥有效成分新藥(new Chinese herbal active ingredient drugs,NCHAIDs)在原《藥品注冊管理辦法》(2002、2005、2007 年)中是中藥注冊分類的一個單獨類別。2020 年,國家市場監管總局頒布的新《藥品注冊管理辦法》(國家市場監督管理總局令第27 號)將中藥注冊分類調整為中藥創新藥、中藥改良型新藥、古代經典名方中藥復方制劑、同名同方藥 4 類[1]。同年國家藥品監督管理局發布《中藥注冊分類及申報資料要求》,將中藥有效成分及其制劑歸入中藥創新藥 1.2 類“從單一植物、動物、礦物中提取得到的提取物及其制劑”,不再將有效成分及其制劑單獨作為一類[2]。NCHAIDs 有著不同于中藥復方新藥的特點,是最容易講清楚、說明白中藥作用機制和走向世界的中藥創新藥。本文通過對2005—2021 年 NCHAIDs 的注冊申請及審評情況進行系統的回顧分析,并就其研發策略進行探討,供同行參考。
一、數據來源與方法
1.1 數據來源
NCHAIDs 相關信息源自國家藥品監督管理局藥品審評中心網站的公開信息、國家知識產權局中國專利全文庫(China Patent Full-Text Database,CNTXT)、藥智網和米內網等商業數據庫。
1.2 數據范圍及數據處理
本文以同時符合以下條件的中藥新藥為分析對象:(1)2005 年 5 月 1 日—2021 年 12 月 30 日受理;(2)審評已完成,有明確審評結論;(3)境內申請人提出的新藥臨床試驗申請(investigational new drug , IND ) 及新藥上市申請( new drug application,NDA);(4)注冊分類為中藥 1 類新藥(2020 年 7 月 1 日前受理并進入藥審中心),或中藥創新藥 1.2 類(2020 年 7 月 1 日—2021 年 12 月 31日受理),即新的中藥有效成分及其制劑;(5)相同結構中藥有效成分及其制劑由不同申請人背對背研究后各自分別申請的,分別按不同品種計算;(6)同一品種同時申請多個規格的,按 1 個品種計。采用 Excel 2016 進行統計。
二、數據統計結果
2.1 申請人地區分布
NCHAIDs 申請人(藥品上市許可人)所在地區的申請品種數如下:江蘇省 9 個、解放軍總后勤部衛生部 7 個、北京市 7 個、上海市 4 個、云南省 3個、山東省 3 個、四川省和貴州省各 2 個以及浙江省、廣東省、重慶市、安徽省、河北省、吉林省、青海省各 1 個(合計 44 個)。
2.2 劑型分布
2005—2021 年 IND 中藥有效成分制劑的劑型分布如下:注射劑 18 個(批準 8 個)、膠囊劑 10 個(批準 6 個)、片劑 9 個(批準 4 個)、滴丸劑 2 個(批準 1 個),合計 39 個。IND 中藥有效成分制劑涉及的劑型較為集中,注射劑占比最高。18 個注射劑中有 12 個為 2008 年以前申請 IND 的品種。國家食品藥品監督管理局頒布《中藥、天然藥物注射劑基本技術要求》(國食藥監注 [2007] 743 號)后,再次對注射給藥途徑的合理性提出明確要求,此后,中藥注射劑的申請數量明顯減少[3]。此外,5 個 NDA的 NCHAIDs 中 4 個為注射劑,未獲準上市生產,另一個膠囊劑獲得上市許可。
2.3 功能主治及適應證分布
2005—2021 年受理且已審結的 44 個中藥有效成分制劑(包括 IND 和 NDA)申請的功能主治(同時涉及多個適應證的,按主要適應證計)相對集中在精神神經、腫瘤、心血管疾病,分別為 14、9、8個,3 者合計占比約 70%。申請 NDA 的 5 個NCHAIDs 中,3 個用于腦梗死、1 個用于冠心病心絞痛、1 個用于腫瘤。
申請 IND 的 39 個 NCHAIDs 中,腫瘤 8 個,冠心病心絞痛 7 個,中風、腦梗死 6 個,肺炎、流感發熱 3 個,血管性癡呆 3 個,糖尿病 2 個,急性腎衰 2 個,乙肝急性發作 1 個,其他適應證(包括創傷性休克、肺纖維化、高尿酸血癥、絕經后骨質疏松、類風濕性關節炎、抑郁癥等)7 個。獲準進行臨床試驗的 19 個品種中,腫瘤 3 個、冠心病心絞痛4 個,中風、腦梗死 3 個,肺炎、流感發熱 2 個,血管性癡呆 2 個,糖尿病 12 個,乙肝急性發作 1個,其他適應證 3 個。
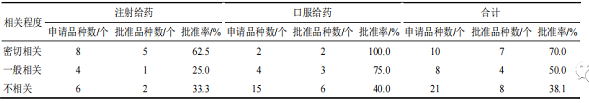
本文對 39 個 IND 的 NCHAIDs 功能主治與所用藥材(以提取物為原料的,按制備提取物所用藥材計)的功能主治進行比較,按照二者的相關程度分為密切相關、一般相關、不相關 3 類。密切相關:新藥制劑的功能主治與藥材功能主治存在相同表述;一般相關:制劑功能主治與藥材功能主治表述相似,根據中醫藥理論推測有相關性;不相關:制劑功能主治與藥材功能主治無相似表述,二者無相關性。從表 1 可知,IND 的 NCHAIDs 中,功能主治與藥材的相關性越高,其批準率越高。
2.4 有效成分用藥材情況
2005—2021 年申請 IND 及 NDA 的 44 個NCHAIDs 共涉及藥材 30 種(以提取物為原料的,按制備提取物所用藥材計)。其中,大多為有效成分明確的常用中藥,出現頻率較高的藥材有丹參、黃芪、銀杏葉、人參、連翹等。NCHAIDs 涉及的 30 種藥材中,能實現規模化種植的有 18 種。其他為未能實現規模化種植的野生藥材。其中,列入《國家重點保護野生植物名錄》的有 3 種。考慮到 NCHAIDs 的生產需要消耗大量藥材資源,應開展野生藥材資源評估工作,關注瀕危藥材及野生藥材的資源可持續利用問題。NCHAIDs 原則上不應以國家重點保護野生動植物為原料,上市生產應以人工栽培藥材入藥。
2.5有效成分的結構類型
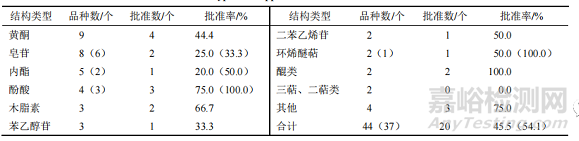
44 個 NCHAIDs(IND 及 NDA)涉及 36 種不同的化合物結構,具體見表 2。表 2 中其他結構類型包括生物堿、聯芐、酚苷等。此外,NDA 有皂苷、黃酮各 2 個、內酯 1 個。
▲ 表 1 2005—2021 年 IND 的 NCHAIDs 的批準率與藥材功能主治間的相關性
▲ 表 2 2005—2021 年中藥 NCHAIDs 的結構類型及批準情況
表中括號內的數據為去除相同結構有效成分后的品種數或相應批準率
2.6 生物利用度
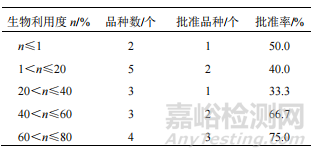
生物利用度是 NCHAIDs 給藥途徑和劑型選擇的重要依據。21 個制備成口服固體制劑的 NCHAIDs中,除 4 個未能獲得公開數據外,其余 17 個有效成分口服固體制劑的生物利用度見表 3(大鼠、犬的生物利用度不同時,按生物利用度高的數據計)。其中,生物利用度小于 1%獲批 IND 的新藥結構為苯乙醇苷類;生物利用度為 1%~20%的 2 個獲批新藥中,分別為皂苷和醌類成分(生物利用度為 9.7%)。苷類成分原型的吸收利用往往較差,而代謝產物相對較好。如某黃酮苷類 NCHAIDs 原型成分的生物利
▲ 表 3 2005—2021 年申請 IND 中藥 NCHAIDs 口服固體制劑的生物利用度情況
用度小于 1%,但加上代謝產物后的生物利用度提高為 28%。除未考察代謝產物的苷類成分外,生物利用度相對較高的品種與生物利用度較低的品種相比,批準率有增加的趨勢。
此外,部分有效成分制劑的生物利用度在 2 種動物(大鼠、犬或猴)間,或不同性別動物間的差異較大。如某生物堿的生物利用度為犬 6.8%、大鼠57.0%。某萜類成分的生物利用度為雌性大鼠 30%、雄性大鼠小于 2%。提示某些有效成分的吸收利用存在明顯的種屬或性別差異。這些品種及生物利用度較低的品種如獲準開展臨床試驗,應結合動物藥動學研究結果有針對性地加強人體藥動學研究。
2.7 日用劑量分布
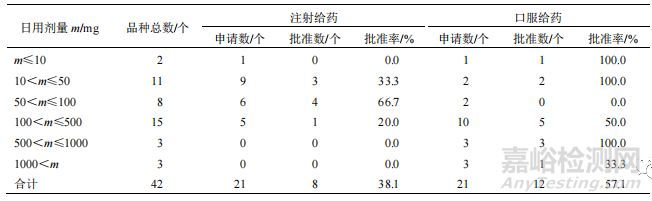
44 個 NCHAIDs 中,有 42 個根據前期研究初步提出了臨床擬用劑量,見表 4。從有效成分的日用劑量與給藥途徑的關聯看,有效成分口服給藥的日用劑量較大,注射給藥的日用劑量相對較低。日用劑量超過 500 mg 的品種均為口服制劑。
▲ 表 4 2005—2021 年 NCHAIDs 的日用劑量情況
2.8 開展臨床試驗情況
2005—2021 年已審結的 39 個 IND 有效成分制劑中有 19 個品種獲批。假設中藥 NCHAIDs 自IND 獲批至申請 NDA 的時間段為臨床試驗所用時間(T):T≤3 年的有 3 個品種(2 個已登記臨床);3 年<T≤5 年的有 9 個(均登記臨床);5 年<T≤10 年有 3 個(均登記臨床);T>10 年有 4 個(2 個登記臨床)。有 3 個尚未進行臨床試驗登記(其中2 個品種已超過 3 年,1 個品種雖未登記但已完成上市申請)。
國家藥品監督管理局藥品審評中心網站“藥物臨床試驗登記與信息公示平臺”[6]顯示(截至 2022年 6 月 30 日):已登記臨床試驗的 16 個品種中,I期臨床試驗已完成 5 個,招募中 5 個;II 期臨床試驗已完成 1 個,招募中 3 個;臨床試驗階段不明招募中的 2 個。
16 個已登記臨床試驗品種的平均臨床試驗所用時間(T 平均)約 7 年,且均未開展 III 期臨床試驗。而同期 NDA 獲批中藥復方新藥的 T 平均為 4.3年,約 87%的臨床試驗用時在 6 年以內。中藥NCHAIDs 臨床試驗用時相對較長。5 個已完成 I 期臨床試驗的有效成分的 T 平均約為 7 年,其中,2 個品種已用約 10 年,3 個已用約 5 年;未完成 I 期臨床試驗的 5 個品種 T 平均約 4 年。此外,有 1 個品種已完成 II 期臨床試驗,已用時 12 年;3 個 II 期臨床試驗正在進行中品種的 T 平均約 9 年。
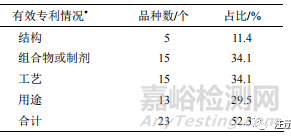
2.9 知識產權情況
CNTXT 收錄了全部公開的中國專利文獻。本文采用申請人結合關鍵詞(中藥有效成分)進行檢索,檢索文獻始于 CNTXT 最早收錄的文獻,止于2022 年 10 月 14 日公開的專利文獻,NCHAIDs 的有效專利數量(專利申請被授權后仍處于有效狀態的專利)見表 5。
▲ 表 5 2005—2021 年 NCHAIDs 的有效專利數量
“*”-新藥申請人擁有的目前仍處于有效狀態的專利
從中藥 NCHAIDs 擁有的有效專利數量來看,44 個 NCHAIDs 中,僅 23 個新藥品種擁有有效專利,占比約 52.3%(其中以個人作為申請人的藥品專利不在統計范圍)。其中結構專利占比最低,僅11.4%。用途專利占 29.5%。主要原因是大部分中藥有效成分為已知成分且用途也被公眾所熟悉,無法滿足現有專利法關于新穎性和創造性的要求,因此難以獲得專利保護。其中也有專利工作較好,如某新藥,有效專利總數 16 個,其中,結構專利 3 個,用途專利 7 個,工藝、組合物或制劑專利各 3 個。
三、討論
3.1 NCHAIDs 研發應加強基礎研究
目前申請注冊的 NCHAIDs 的基礎研究普遍較為薄弱,尤其是藥物發現階段的基礎研究不夠充分。盡管相應藥材有長期人用歷史,與天然產物相比,從藥材中發現有效成分的幾率可能相對較高,但一種藥材往往含有幾百或更多的成分,從中找出最適合開發成 NCHAIDs的某一種成分是非常具有挑戰性的科學研究。NCHAIDs 的研發規律與天然藥物及小分子化學藥更為相近,不能完全根據藥材的臨床經驗來推測其有效性。如何實現藥材中的微量成分的高效分離、快速識別及高效活性篩選,都是需要解決的問題。新藥發現階段的研究非常重要,有效成分一旦確定,在很大程度上決定了今后新藥的安全性、有效性。應加強基礎研究,充分利用現代科學技術進步帶來的新手段、新技術、新方法,如基于靶點的高通量篩選[7]、高內涵篩選[8]、釣靶技術[9]、分子對接技術[10]、網絡藥理學[11-12]、細胞膜色譜[13]、人工智能[14]、微流控芯片[15]、基因芯片[16]等。
3.2 NCHAIDs 研發應重視成藥性研究
有些 NCHAIDs 在研發中缺少成藥性研究。僅從藥材中發現活性成分后就匆匆立項,未考慮到有效成分雖有活性但未必適合開發成新藥。從技術要求看,NCHAIDs 與小分子化學藥已基本趨同。盡管從藥材中發現的多數活性成分具有一定藥效,但很多情況下藥效作用強度較弱,或藥代性質、安全性等方面存在缺陷,臨床應用價值不大[17]。尤其是常用中藥材,其中含量較高的成分早已被反復研究,成藥性往往較差,不宜盲目開發。新藥研發的投資大、周期長、風險高,應在研發立項及關鍵節點就成藥性進行綜合評估,合理控制研發風險。
3.3 NCHAIDs 研發應關注藥物吸收利用
較強的生物活性與良好的藥代性質是NCHAIDs 應具備的特征。NCHAIDs 是最有希望成功使用新劑型、新輔料、新技術的中藥注冊分類。應加強 NCHAIDs 的藥動學研究,鼓勵采用現代制劑技術和合適輔料改善其生物利用度。應根據有效成分特點、生物藥劑學分類及藥代行為合理選擇制劑技術及輔料。已有相關研究可為 NCHAIDs 的研究提供思路和借鑒。Ma 等[18]采用高相對分子質量羥丙基甲基纖維素等輔料制備穿心蓮內酯的固體分散體,其最大血藥濃度(Cmax)、藥-時曲線下面積(area under curve,AUC)分別提高了 6.0、4.7倍。Gera 等[19]以聚乙烯吡咯烷酮為穩定劑制備了柚皮素納米混懸劑,其 Cmax 及 AUC 分別提高 2.0、1.8 倍,改善了溶出度和口服生物利用度。Aboutaleb等[20]將長春新堿硫酸鹽與聚陰離子右旋糖酐硫酸鈉結合到棕櫚酸脂質納米粒中制成長春新堿的固體脂質納米粒,與藥物溶液相比,其血漿及組織中藥物濃度提高,停留時間延長。Zhang 等[21]以聚乙二醇及二硬脂酰磷脂酰乙醇胺制成硫酸長春新堿納米制劑,顯著延長其半衰期、增大 AUC。Wei等[22]以羥丙基甲基纖維素為沉淀抑制劑制備了過飽和水飛薊賓自乳化給藥系統,在給藥劑量為 533mg/kg 時,水飛薊賓過飽和自乳化給藥系統比不含羥丙基甲基纖維素的自乳化給藥系統相比,AUC增加約 3 倍。
3.4 NCHAIDs 研發應關注資源與成本
以藥材為起始原料且得率及用法用量明確的34 個 NCHAIDs 中,口服制劑每日消耗的飲片量最高約 2000 g,注射劑每日消耗的飲片量最高為 740g。以野生藥材為原料的 NCHAIDs 應特別關注藥材資源能否可持續利用及對生態環境的影響。根據“中藥材天地網”2022 年 1 月不同藥材產地、不同藥材市場的平均價格計算,日服飲片量最多的 NCHAIDs每日給藥劑量所需的藥材平均成本約為 180 元。定向培育有效成分含量高的藥用植物品種、改進工藝提高有效成分的提取得率,或采用合成生物學技術獲得有效成分,或以有效成分為先導化合物,進行結構改造,研發新的化學藥等,都可能是解決資源或成本問題的方法。
3.5 NCHAIDs 研發應重視知識產權保護
隨著知識產權在保證研發投入回報及創新發展中作用的日益凸顯,NCHAIDs 研發應建立知識產權保護的“護城河”,對于產品的有效專利予以充分重視。對于新研發的中藥有效成分結構,可先爭取獲得結構專利作為基礎專利,然后再從制劑、組合物、制備工藝、用途等方面進行全方位專利布局,獲得多維度保護。對于已知有效成分的中藥新藥,即便不能獲得結構專利,也可以進一步研究劑型、組合物、用途等專利,建立多重外圍專利保護網。
四、結語
本文通過對 2005—2021 年中藥有效成分 IND、NDA 的審評審批情況和臨床試驗登記情況進行分析和研究,結果顯示:(1)據不完全統計,2005—2021 年 NCHAIDs 申請臨床試驗的 39 個品種中有19 個獲得批準,批準率為 48.7%。IND 獲批品種中有 16 個已進行臨床試驗登記。5 個 NDA 品種中,4 個注射劑未獲批準,另 1 個膠囊劑獲準上市生產。(2)NCHAIDs 申請的適應證相對集中在精神神經、心血管、腫瘤;臨床定位與藥材相關的有效成分獲得 IND 批準的比例相對較高。(3)有效成分的結構類型較多,黃酮、皂苷、內酯等的占比較高。(4)NCHAIDs 臨床試驗用時較長。16 個已完成臨床試驗登記品種的 T 平均約為 7 年,有 1 個品種完成了 II期臨床試驗,5個完成了I期臨床試驗。(5)NCHAIDs擁有有效專利數量較少。44 個 NCHAIDs 中,僅 23個新藥品種擁有有效專利,占比約 52.3%。其中結構專利僅占 11.4%。用途專利占 29.5%。
中藥新藥的研究與評價應以患者為中心,以臨床價值為導向。NCHAIDs 研發應加強基礎研究,重點加強新藥的成藥性研究,控制研發風險。重視有效成分的藥動學研究,采用新劑型、新技術增加藥物吸收利用。關注 NCHAIDs 用藥材資源與制造成本等問題。本文對以往 NCHAIDs 注冊申請及審評情況的回顧分析,為今后 NCHAIDs 的科學審評積累經驗,為 NCHAIDs 的研發提供有益參考。
參考文獻
[1] 國家市場監督管理總局. 《藥品注冊管理辦法》(國家市場監督管理總局令第 27 號) [EB/OL].[2020-03-20].
http://gkml.samr.gov.cn/nsjg/fgs/202003/t20200330_313670.html.
[2] 國家藥品監督管理局. 國家藥監局關于發布《中藥注冊分類及申報資料要求》的通告 (2020 年第 68 號)[EB/OL]. [2020-09-28].
https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20200928164311143.html.
[3] 國家食品藥品監督管理局. 關于印發中藥、天然藥物注射劑基本技術要求的通知 (國食藥監注 [2007] 743 號)[EB/OL]. [2007-12-06].
https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20071206120001186.html.
[4] 王玲玲, 胡流芳, 張曉東, 等. 2005—2020 年申請臨床試驗中藥新藥的審評審批情況分析 [J]. 中草藥, 2021,52(12): 3765-3774.
[5] 國家食品藥品監督管理總局. 關于開展藥物臨床試驗數據自查核查工作的公告 (2015 年第 117 號) [EB/OL].[2015-07-22].
https://www.nmpa.gov.cn/yaopin/ypggtg/ypqtgg/20150722173601172.html.
[6] 藥物臨床試驗登記與信息公示平臺 [EB/OL]. [2022-12-24].
http://www.chinadrugtrials.org.cn/index.html.
[7] 權寧海, 康英錦, 李東浩, 等. 中草藥活性成分的高通量篩選技術研究進展 [J]. 分析科學學報, 2017, 33(5):741-746.
[8] 王石峰. 抑制 3T3-L1 細胞脂形成的中藥活成分高內涵篩選 [D]. 北京: 北京中醫藥大學, 2014.
[9] 劉翠翠, 王奇升, 田永奇, 等. 配體垂釣: 一種從生物提取物中快速篩選活性化合物的方法 [J]. 藥學學報,2021, 56(4): 996-1005.
[10] 羅菁漢, 吳成軍, 孫鐵民. 采用分子對接技術發現抗冠狀病毒肺炎藥物的研究 [A] // 第十七屆沈陽科學學術年會論文集 [C]. 沈陽: 沈陽市科學技術協會, 2020:262-269.
[11] 王海霞, 康顯杰, 朱燕, 等. 基于網絡藥理學和分子對接技術探討白術治療潰瘍性結腸炎的潛在分子機制[J]. 浙江中醫藥大學學報, 2020, 44(9): 916-923.
[12] 周珊珊, 李偉男, 艾中柱, 等. 基于網絡藥理學和分子對接探討清肺達原顆粒治療新型冠狀病毒肺炎(COVID-19) 的作用機制 [J]. 中草藥, 2020, 51(7):1804-1813.
[13] 王曉宇, 陳嘯飛, 顧妍秋, 等. 細胞膜色譜研究進展及其在中藥活性成分篩選中的應用 [J]. 分析化學, 2018,46(11): 1695-1702.
[14] 吳昊, 林銘, 孫懿, 等. 新一代人工智能技術驅動下的新藥研發 [J]. 中國藥理學通報, 2019, 35(7): 889-893.
[15] 高巖. 微流控芯片用于篩選博落回種子中抗腫瘤活性成分研究 [D]. 廣州: 廣東藥科大學, 2021.
[16] 劉玉峰, 許肈初, 馬海燕. 基因芯片技術在中藥現代化研究中的應用進展 [J]. 遼寧大學學報: 自然科學版,2021, 48(3): 254-262.
[17] 姜勇, 李軍, 屠鵬飛. 再議新形勢下中藥創新藥物的發現與研發思路 [J]. 世界科學技術—中醫藥現代化,2017, 19(6): 892-899.
[18] Ma Y Q, Yang Y, Xie J, et al. Novel nanocrystal-based solid dispersion with high drug loading, enhanced dissolution, and bioavailability of andrographolide [J]. Int J Nanomed,2018, 13: 3763-3779.
[19] Gera S, Talluri S, Rangaraj N, et al. Formulation and evaluation of naringenin nanosuspensions for bioavailability enhancement [J]. AAPS PharmSciTech,2017, 18(8): 3151-3162.
[20] Aboutaleb E, Atyabi F, Khoshayand M R, et al. Improved brain delivery of vincristine using dextran sulfate complex solid lipid nanoparticles: Optimization and in vivo evaluation [J]. J Biomed Mater Res A, 2014, 102(7): 2125-2136.
[21] Zhang J, Chen Y C, Li X, et al. The influence of different long-circulating materials on the pharmacokinetics of liposomal vincristine sulfate [J]. Int J Nanomed, 2016, 11:4187-4197.
[22] Wei Y H, Ye X L, Shang X G, et al. Enhanced oral bioavailability of silybin by a supersaturatable self emulsifying drug delivery system (S-SEDDS) [J]. Colloids Surf A Physicochem Eng Aspects, 2012, 396: 22-28.