在任何情況下,藥品設計都應該符合患者的需求,達到預期的產品性能。藥品研發的策略因公司而異,也因產品而異,藥品研發的步驟和范圍也各不相同,這些信息均應在申報資料中予以介紹。申報者可以根據歷史經驗,也可以采用更具系統性的方法(或者二者結合)進行藥品研發。
采用QbD方法進行藥品研發,目標是減少產品變異和缺陷,并通過研發可靠的產品和生產工藝,建立與臨床表現相關的質量標準,并提高研發效率,減少產品批準后變更。其組成部分包括QTPP (確定目標藥品質量概況),產品CQA(明確潛在的制劑的關鍵質量屬性),產品開發和理解(確定原料藥、輔料等的關鍵質量屬性(CMA)), 工藝開發和理解(選擇合適的生產工藝), 確定控制策略和持續改進等,最終產品和生產工藝得到評估,并在批準后的產品和工藝生命周期管理中得以不斷改進。
下圖是基于QbD方法的研發步驟
下面將對研發步驟進行詳細的闡述
1.確定目標產品質量概況
基于原料藥屬性和參比制劑特性以及參比制劑說明書與預期患者人群確定QTPP,目標產品質量概況是產品研發的設計基礎。確定目標產品質量概況應考慮的因素包括:
預期的臨床用途,給藥途徑,劑型,給藥系統;
劑量規格;
容器密閉系統;
適合于所研發藥品劑型的治療活性成分的釋放或傳輸, 以及影響藥代動力學特性(如:溶出度,氣動性能)的屬性。
適合于擬定上市產品的藥品質量標準(如:無菌性,純度,穩定性和藥物釋放)。
2.確定產品關鍵質量屬性
關鍵質量屬性(CQA)是應該在適當的限度、范圍或分布之內的物理、化學、生物或微生物性質或特征,用以確保所需的產品質量和臨床的有效性與安全性。一般來說,CQA 與原料藥、輔料、中間體 (過程中物質)和藥品相關。一個屬性是否為CQA取決于當該屬性超出可接受范圍時由風險評估獲得的該屬性對臨床有效性和安全性的影響程度和不確定性,下圖是產品CQA決策樹。
3.產品開發
3.1處方前研究
3.1.1參比制劑剖析
對參比制劑進行理化剖析確定參比制劑外觀、規格、片重、片徑、片厚、有無刻痕、有無包衣、硬度、崩解等物理特性及含量、有關物質、溶出度、溶出曲線等化學特性。
根據對參比制劑說明書、專利文獻和對參比制劑的逆向分析,確定參比制劑處方及處方量。
3.1.2原輔料性質和風險評估
原料藥:確定其物理性質(性狀、晶型、熔點、溶解度、吸濕性、密度、流動性)、化學性質(pKa、化學穩定性)生物學特性(分配系數、細胞滲透率、BCS分類)。
對原料藥屬性進行風險評估:在研發階段一般采用低、中、高風險分級系統評估相對風險。低:為可接受的風險,無需進一步研究;中、為風險可接受,可能需要進一步研究以降低風險;高:為風險不可接受,需要進一步研究以降低風險。通過風險評估,確定原料藥的高風險屬性,從而確定需要進行哪些研究,來增加對產品和工藝的理解,建立相應的控制策略。對物料屬性的風險評估主要基于物料的理化和生物學特性等對產品CQA的影響。對產品CQA有明顯影響的極為高風險屬性。下表為仿制藥A片劑原料藥屬性的風險評估實例,由于各制劑所用原輔料的特性,該風險評估額合理性說明不在闡述。
輔料:輔料是制劑的重要組成部分輔料的某些性質如粒度及粒徑分布、密度、流動性、水分等會對某些關鍵質量屬性產生明顯影響。因此,對可能影響制劑CQA的輔料屬性應進行詳細分析和評估。在進行輔料風險評估前應根據參比制劑處方組成進行原輔料相容性試驗,根據實驗結果選擇可以與原料藥相容的輔料進行輔料屬性評估。下表為某仿制藥A片劑各輔料屬性的風險評估實例:
一般制劑處方中,填充劑為乳糖和微晶纖維素,且二則者處方中占比較大,在片劑直壓工藝中,其粒度及粒徑分布、流動性有可能影響藥品的含量均勻度,故應對二者的粒徑分布、流動性進行重點進行評估。在處方中潤滑劑一般為硬脂酸鎂,但是硬脂酸鎂具有疏水性,并能阻滯藥物從固體制劑中溶出,在硬脂酸和片劑顆粒混合時,混合的變異系數增加,溶出速度降低,混合時間增加,片劑溶出速度和破碎強度降低,硬脂酸鎂也可能增加片劑的脆碎度。故應對其等級進行重點評估。
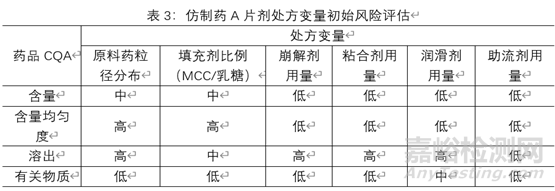
3.1.3處方變量初始風險評估:某仿制藥A片劑示例見下表,由于各制劑特性及所用輔料的特性,該風險評估額合理性說明不在闡述。
3.2處方開發和理解
根據表:處方變量初始風險評估結果,對評為高風險的處方變量進行研究。
3.2.1考察不同原料藥粒徑分布對含量均勻度和溶出的影響
3.2.2考察填充劑比例(MCC/乳糖)對含量均勻度的影響
3.2.3考察崩解劑用量對溶出的影響
3.2.4考察粘合劑用量對溶出的影響
3.2.5考察潤滑劑用量對溶出的影響
3.2.6處方變量風險評估更新
根據對各高風險處方變量的考察,確定了高風險處方變量的可接受范圍,并將它們納入控制策略之中下表總結了某仿制藥A片劑處方變量風險評估更新,由于各制劑特性及所用輔料的特性,該風險評估額合理性說明不在闡述。
4.工藝開發
4.1根據對參比制劑說明書、專利文獻和對參比制劑的逆向分析,確定參比制劑工藝及工藝步驟。對于普通片劑,選擇合適的工藝:直壓工藝、干法制粒、濕法制粒、流化制粒等。通過分析小試選擇干法制粒工藝進行工藝研究。
下圖列出了輸入物料屬性CMA和工藝參數CPP與產品關鍵質量屬性CQA之間的關系:


4.2工藝變量初始風險評估
基于對臨床有效性和安全性的考慮,確定可能被工藝步驟影響的產品CQA和確定影響產品CQA的每個工序工藝步驟中的輸出物料(中間體)CQA,并對影響中間體CQA的物料屬性和工藝參數進行風險評估,對評為高風險的物料屬性和工藝參數進行研究,以便優化生產工藝并降低產品CQA不合格的風險。對整個生產工藝的風險評估結果見表5,由于各制劑特性及所用輔料的特性,該風險評估額合理性說明不在闡述。
4.3對評為高風險工藝步驟的工藝參數進行評估,將影響中間體CQA的物料屬性和工藝參數評為高風險,對并這些高風險物料屬性和工藝參數進行研究。
工藝變量風險評估更新
4.4根據對各高風險物料屬性和工藝參數的考察,確定了高風險物料屬性和工藝參數的可接受范圍,并將它們納入控制策略之中下表總結了某仿制藥A片劑處生產工藝風險評估更新,由于各制劑特性及所用輔料的特性,該風險評估額合理性說明不在闡述。