2022年全年,FDA一共批準(或暫時性批準)了914個ANDA,其中暫時性批準172個,正式批準742個。從數量上看,相比2021年的669個有明顯的提升,但仍然不及2017-2020年間的水平。由于美國仿制藥競爭高度激烈,仿制藥的投資回報率較低(就如FDA報告中所說,普瑞巴林膠囊的平均價格在一年內下降了95%),故近年來ANDA的申報積極性有所回落,而且近35%的產品從來沒有在美國上市。因為競爭過于激烈,近年來仿制藥都是拼首仿,比難度的游戲,盡管只有為數不多的幾個產品面臨專利懸崖,但FDA已經提前批準了“暫時性的”ANDA。
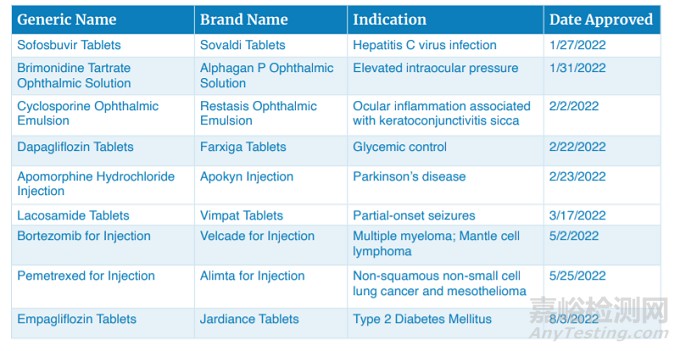
2022年,FDA仿制藥辦公室一共批準了106個首仿藥,其中意義最為重大的仿藥包括索非布韋片、溴莫尼定滴眼液、環孢素滴眼液、達格列凈片、阿撲嗎啡注射液、拉考酰胺片、注射用硼替佐米、注射用培美曲塞、恩格列凈片等。
具有重大意義的首仿藥
2015年之后,價格下降導致的市場萎縮超過了銷量增長所帶來的增量,美國仿制藥市場開始逐漸萎縮,但為了進一步增加仿制藥競爭,FDA制定了一攬子的“藥品競爭行動計劃”(FDA Drug Competition Action Plan)。雖然FDA加大了仿制藥的審批,但制藥企業對幾乎“無利可圖”的美國仿制藥喪失了積極性,為了進一步加大仿制藥的競爭,FDA也是“操透了心”,通過各種措施來提高仿制藥的積極性,為高度復雜產品審評審批進行了多種嘗試,發布或修訂了大量的產品專業指南(product specific guidance)。
FDA新發或修訂的產品專業指南
FDA 仿制藥審評辦公室2022年的業績