您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-09-01 19:56
固體分散體是指藥物與載體材料形成的無定形或者晶體狀態的分子分散系統,主要分為低共熔混合物、固體溶液、無定形共沉淀物以及玻璃溶液四類。
考慮到載體和API的物理狀態和分子排列,我們可以把二元固體分散體分為六個不同的體系:
(1)C-C類:晶體原料藥分散在晶體載體中
(2)C-A類:晶體原料藥分散在無定形載體中
(3)A-C類:無定形原料藥分散在晶體載體中
(4)A-A類:無定形原料藥分散在無定形載體中
(5)M-C類:原料藥分子分散在晶體載體中(6)M-A類:原料藥分子分散在無定形載體中。
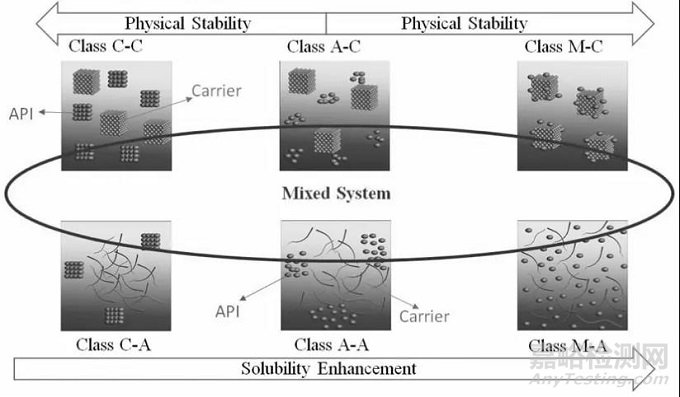
圖1 根據載體及API物理結構對二元固體分散體進行分類
固體分散體穩定性的影響因素
我們知道,無定形狀態的原料藥穩定性要差于結晶狀態的原料藥。
我們為了提高藥物的溶解度,很多時候制備的固體分散體都是無定形的,也就是非晶體固體分散體。所以這個時候我們應該重點關注,在我們產品的效期內,我們的原料藥是否發生結晶。
如果發生結晶現象,對我們的產品質量是否發生影響(如藥物的崩解、溶出、有關物質以及體內吸收等)?如果對產品質量有一定的影響,則需要保證產品效期內原料藥不發生結晶現象。
固體分散體的穩定性如此重要,這就需要我們在設計體系的時候多加注意。
由于C-C類和C-A類原料藥已經處于結晶狀態,因此物理不穩定性一般不會成為問題。我們應側重于其他系統的物理穩定性。
在預測固體分散體的物理穩定性時,應考慮API的結晶傾向、玻璃化轉變溫度、分子遷移率、相互作用等重要因素。
(1)結晶傾向
對于晶態材料而言,玻璃形成能力(即處于非晶態的能力)和玻璃穩定性(即抗重結晶穩定性)反映了其固有的晶化傾向。
低結晶傾向的原料藥更容易配制成A-A類、A-C類或M-A類固體分散體。而對于高結晶傾向的原料藥,通常會形成A-C類、A-A類或M-C類固體分散體,因為高結晶傾向的原料藥很難轉變為非晶態。
原料藥轉化為無定形狀態的難易程度主要取決于其分子結構的固有玻璃形成能力。但是即使藥物具有較高的結晶傾向,聚合物載體的加入也有助于其形成穩定的無定形分散體。
在針對特定原料藥設計高效固體分散體時,我們需要考慮載體選擇、載藥量和生產條件三個因素。
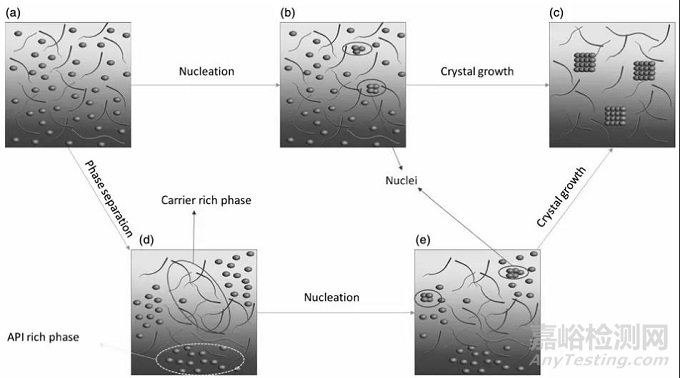
圖2 結晶機理
(2)玻璃化轉變溫度
晶體向玻璃的轉變也稱為非晶化。
載體通常通過與原料藥分子形成分子相互作用而起到有效的抑制結晶的作用,載體的使用也可能影響固體分散體中原料藥的玻璃化溫度。
玻璃化溫度的增加可能會降低固體分散體系的分子遷移率,可能增加藥物的物理穩定性。
(3)分子遷移率
結晶可分為兩個獨立但是相互依賴的的過程,即成核和晶體的生長。
這兩個過程需要分子運動導致分子重排,從而形成穩定的晶核,或附著在生長的晶面上;因此,分子遷移率是非晶態體系物理穩定性的關鍵參數。
分子遷移率是一個與溫度和濕度密切相關的參數,它會受到制造或儲存條件以及所在體系中的物理化學性質的顯著影響,如環境溫濕度、固體分散體吸濕性等因素。
分子遷移率與物理穩定性直接相關。
(4)原料、載體相容性
原料與載體的相容性是選擇載體的基礎,一般原料與載體的相容性越高,則更加容易制備成固體分散體。
目前研究原料與載體相容性的方法有溶解平衡常數的測定以及熱分析法。
使用溶解平衡常數的測定法時,一般最后也需要使用熱分析法進行最后的確認。
當使用差示掃描量熱法檢測原料與載體的相容性時,如果原料與載體的相容性良好,則固體分散體混合物會產生一個介于原料與載體之間的玻璃化轉變溫度(Tg)值,并且只有一個;當原料與載體的相容性不好時,則會產生兩個或兩個以上的吸熱熔融峰,且吸熱熔融峰相互間是分離開的。
固體分散提高藥物溶解度機制
目前大家對固體分散體進行了大量的研究,但對固體分散體改善難溶性藥物溶解度機理的研究還很少,下面我們來了解下固體分散體提高藥物溶解度的機制吧。
(1)通過減小藥物粒徑
提高藥物在水中的表觀溶解度的最簡單方法之一是減小其顆粒大小。
粒徑減小導致顆粒比表面積增大,從而增加了與溶解介質的接觸,提高了其表觀水溶性。
固體分散體顆粒可以減少團聚,從而改善藥物溶解性。例如,阿苯達唑與泊洛沙姆407或PEG 6000的固體分散體,由于粒徑減小和潤濕性增加,藥物的表觀溶解度增加。
(2)通過改變藥物晶型
一些固體分散體通過改變藥物晶型來改善藥物的表觀水溶性和溶出度,一般將藥物的由穩態的晶型轉為亞穩態的晶型或無定形。這樣就表現出比結晶藥物更高的溶解度。
固體分散體提高難溶結晶藥物表觀溶解度最常見、最重要的機制是將其轉化為無定形狀態。
熱力學上,與其相應的晶態相比,非晶態固體具有更高的瞬時溶解度、溶解速率、蒸汽壓和分子遷移率。
(3)通過載體、藥物或介質pH
固體分散體的溶出度可以由載體控制、藥物控制或生理介質控制。
例如鹽酸去甲替林在聚乙二醇3400為載體的固體分散體中的溶出速率,與PEG濃度和分子量有關,表明溶出速率是由載體控制的。
在灰黃霉素與PEG的固體分散體系中,灰黃霉素的溶出速率取決于灰黃霉素的顆粒大小,從而表明溶出速率是藥物控制的。
消炎痛與載體乙基纖維素的固體分散體系中,在較低pH的介質中消炎痛的釋放被延緩,從而表明溶解速率受生理介質pH的控制。

圖3 固體分散提高藥物溶解度機制
制備方法
制備固體分散體的方法很多,包括共磨法、熔融法、溶劑蒸發法和共沉淀法。制備方法的選擇是至關重要的,每一類固體分散體的制備方法選擇策略如圖4所示。

圖4 固體分散法制備方法的選擇策略
(1)共磨法
共磨法是一種低成本、易于操作的固體分散體制備方法。在這種方法通常原料藥和載體在帶有不銹鋼罐和球的磨機中混合,經過數小時的磨制,得到最終產品。
共磨方法能顯著減小藥物顆粒的尺寸,并能使藥物由晶態轉變為非晶態。共磨法制備的固體分散體藥物-載體相互作用最少,但是物理穩定性最差。
(2)熔融法
熔融法是制備固體分散體最早也是最常用的方法之一。將原料藥與不同載體熔融,經過冷卻、粉碎、篩分等一系列工序,制得固體分散體粉末。
但是傳統的熔融法有兩個嚴重的局限性:
①熔融過程需要較高的溫度,在生產過程中可能會發生原料藥或載體的降解或分解。例如,用熔融法獲得槲皮素固體分散體需要300℃左右的溫度,而常用的聚合物在這樣的溫度下可能會降解。因此,熔點較高的藥物可能不適合采用熔融法。
②熔融法只有在藥物和載體在熔融狀態下可混溶時才能使用,如果藥物和載體不能相容,則可能在熔融的混合物中形成兩個液相或懸浮液,從而導致非均相固體分散體的形成。
因此,結晶或半結晶載體,如聚乙二醇(PEG)、泊洛沙姆由于其與結晶API相似的理化性質,在熔融方法中被廣泛使用。
(3)溶劑法
溶劑法是一種常用的小規模制備固體分散體的方法,涉及API和載體在揮發性溶劑中的增溶作用。
這種方法,可以防止原料藥或聚合物的熱降解,因為該過程可以在不過度加熱的情況下進行。
溶劑揮發法的基本過程包括兩個步驟:
①將API和載體的物理混合物溶解在普通溶劑或溶劑混合物中;
②去除溶劑以獲得固體混合物。
溶劑法目前有個主要的挑戰,限制了它在固體分散體的大規模生產中的應用。即API和載體溶于到一溶劑中,如果原料藥和載體在極性上有很大的不同,就會變得非常困難。
所以為了避免浪費物料,在使用溶劑法之前,我們可以先對藥物和載體在選定溶劑中進行少量溶解。
可以溶解最大量的API-載體物理混合物的揮發性溶劑是首選溶劑。通常使用低沸點的溶劑,如甲醇、乙醇、二氯甲烷、丙酮和氯仿或它們的混合物。
預熱溶劑或持續緩慢加熱可以提高物理混合物的溶解度,有助于形成更均勻的體系。隨后采用真空干燥、噴霧干燥、冷凍干燥等方法進行固體分散體的制備。
在真空干燥方法中,溶液在中溫(通常為50~80℃,取決于溶劑)下真空干燥,形成的固體分散體通常儲存在真空干燥器中,以完全除去殘留的溶劑。有時使用旋轉蒸發器或烘箱來加速干燥。
在噴霧干燥方法中,API載體溶液被霧化成細小的液滴,并噴入加熱氣流中以除去溶劑。由于液滴的比表面積大,溶劑可以迅速脫除,形成細小的固體分散顆粒。
除了快速蒸發外,噴霧干燥技術的另一個優點是顯著減小了顆粒尺寸。噴霧干燥制得的最終顆粒的大小與液滴大小直接相關,我們可以通過改變噴液速度、改變溶液濃度等方式來控制所得顆粒的大小。
冷凍干燥,又稱升華干燥,是制備固體分散體的一種重要方法,因為它可以在較低的溫度下操作,可以有效地降低相分離和降解的風險。
載體的選擇
載體的選擇主要考慮三方面因素,即安全性、動力學和熱力學方面。
傳統觀點認為,任何用于藥物配方的賦形劑在化學和藥理上都應該是惰性的,這也同樣適用于固體分散體制備中對載體的選擇。
首先從安全性方面考慮,所選載體在人體內必須是安全的。從動力學角度看,該載體應該能夠抑制藥物在胃腸道環境中轉晶或沉淀。從穩定性的角度來看,熱力學因素對于無定形固體分散體的物理穩定性是比較重要的。
聚合物必須具有較高的玻璃化轉變溫度,以便制備的固體分散體在室溫下具有良好的穩定性。
(1)聚乙烯比咯烷酮
聚乙烯吡咯烷酮是配制固體分散體最常用的載體之一。它是一種具有無定形物理狀態的親水聚合物,它可溶于水、乙醇、異丙醇和氯仿。
由于在揮發性溶劑如乙醇中的溶解性,聚乙烯吡咯烷酮適用于通過溶劑法制備固體分散體。
聚乙烯吡咯烷酮的玻璃化轉變溫度與其分子量成正比。
大多數高分子量聚乙烯吡咯烷酮通常具有高玻璃化轉變溫度(Tg),高玻璃化轉變溫度使得它不適合熔融法制備固體分散體,特別是對于低熔點和熱不穩定的藥物。
(2)共聚維酮
共聚維酮是乙烯基吡咯烷酮和醋酸乙烯酯的共聚物,是一種無定形的水溶性聚合物。
由于醋酸乙烯酯取代基的親水性相對較差,所以聚維酮親水性也較差,所以能夠與具有不同極性的多種原料藥表現出相似溶解性。
而且聚維酮的玻璃化轉變溫度在100℃左右,而降解溫度大約需要230℃,由于聚維酮玻璃化轉變溫度與降解溫度相差較大,這為熔融法提供了機會.
我們可以通過熔融法,使用共聚維酮作為載體來制備固體分散體。
(3)聚乙二醇
聚乙二醇是分子量在200~300000g/mol的環氧乙烷聚合物。
聚乙二醇的物理狀態取決于其分子量。分子量在600以下的聚乙二醇在室溫下為粘性液體,而分子量在8000和20000以下的聚合物分別為蠟質和干固體。
聚乙二醇是一種半結晶聚合物,其結構中既有結晶結構域,又有無定形結構域。
聚乙二醇具有55~68°C的低熔點,在水中以及許多揮發性有機溶劑,如甲醇、乙醇和氯仿中具有良好的溶解性。
由于聚乙二醇在許多揮發性有機溶劑具有良好的溶解性,所以適用于溶劑法制備固體分散體。
由于聚乙二醇熔點較低,所以適用于與低熔點藥物通過熔融法制備固體分散體。
(4)纖維素衍生物
纖維素衍生物是制備無定形固體分散體常用的載體。
纖維素衍生物由于分子量高,所以不能從胃腸道吸收,并且纖維素衍生物具有與藥物分子相互作用強以及玻璃化轉變溫度高的特性。
常用的有甲基纖維素(MC)、乙基纖維素(EC)、羥丙基纖維素(HPC)等。
(5)羥丙基甲基纖維素
HPMC屬于纖維素類聚合物的一個大類。
HPMC是一種非離子型親水性聚合物,可溶于水和大多數有機溶劑,包括甲醇、乙醇、丙醇和二氯甲烷。
由于HPMC在有機溶劑中易溶,適合噴霧干燥來制備固體分散體。
由于HPMC的水溶解性,適合冷凍干燥技術來制備固體分散體。
雖然純纖維素是半結晶的(結晶度為50-60%),但HPMC是以無定形狀態存在的,其玻璃化轉變溫度達到180°C,因此HPMC不適合熔融法制備固體分散體。
在我們藥物研發過程中,不可避免的會遇到難溶性的藥物溶解度差的問題,希望當遇到這個問題而沒有頭緒時,小編的一篇文章可以為大家提供一點點思路。

來源:銘研醫藥


