您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-02-09 08:41
仿制藥在各國政府的大力推動下蓬勃發展。特別是近年來,諸多“重磅炸彈”級品牌藥專利的集中到期,加劇了國際仿制藥市場特別是美國等主流市場的競爭,更是成為我國醫藥企業培育出口新優勢的難得契機。為降低藥品市場價格,使需求人群能夠更容易、更便利地獲得急需的各種藥品,各國政府積極鼓勵仿制藥企業對品牌藥進行仿制。美國政府設立了專利挑戰機制和嚴格而精巧的仿制藥審批制度,即簡明新藥申請(abbrevitive new drug application,ANDA)。中國政府推薦優先審評同時申報中美的仿制藥和/或采購進行可專利挑戰的仿制藥。
對于一個藥物來說,專利申請的數量往往非常巨大,既包括核心專利,通常為化合物專利,也包括外圍專利,如晶型、制劑、工藝專利等;各專利的關系錯綜復雜,而且一篇專利往往在多國申請,各個國家針對相同專利的權利要求范圍以及法律狀態各異,這就進一步增加了專利情況的復雜性。即使核心專利已經過期,但大量外圍專利仍然處于有效狀態,繼續阻礙仿制藥廠家的仿制藥品上市,仿制藥廠家仍然難以無風險地提早上市產品。
1.1 仿制藥開發的專利挑戰機制
醫藥產業是我國培育戰略性新興產業的重點領域,極具發展潛力。近年來,不少有遠見的藥企選擇開發歐美仿制藥,尤其是開發美國市場的第一家仿制藥(首仿藥)。提到美國首仿藥,就不可避免地要探討其與美國《藥品價格競爭和專利期延長法》(也稱“Hatch-waxman法案”)的關系。美國的《藥品價格競爭和專利期延長法》明確規定,ANDA申請者可以通過發起專利挑戰,謀求獲得更有利“席位和收益”:第一家提交ANDA申請且挑戰專利的公司,可獲得相對優先的審評席位和有可能獲得市場專賣權;其中的挑戰專利即為在新藥獲批后的第5年的d1遞交ANDA申請,同時根據橙皮書(orange book,OB)中列出的藥品的相關專利,采取第四段聲明——聲明相關專利無效或者不侵犯相關專利(即通常所述的PIV聲明)。在美國,一方面新藥擁有者可以獲得由于FDA審批耽誤時間的補償;另一方面,為了激勵仿制藥的開發,規定如果第一家仿制藥廠商(即首仿藥申請者)能夠采用第四段聲明挑戰專利并且成功,則可以獲得180d的市場專賣權,而不挑戰專利的ANDA申請人,不能在新藥獲批后的第5年d1遞交ANDA申請,而是需要在新藥獲批5年后才能遞交ANDA申請。專賣權過后,其他仿制藥才可以上市銷售。
1.2 中國藥企仿制藥專利挑戰現狀
從國際經驗來看,仿制藥企業通過首仿專利挑戰取得藥物上市,不僅為企業贏得了巨額利潤,也通過技術和資金的積累,為企業下一步新藥研發創新提供了重要支撐。因此,在當今醫藥市場多方博弈的競爭格局中,我國醫藥企業在美國提交ANDA申請,開展仿制藥專利挑戰,爭取180 d獨占期,不僅能夠以相對較小的成本賺取比普通仿制藥以及國內仿制藥品更高額的利潤回報,獲得與輝瑞公司、默克公司、梯瓦公司等跨國藥業巨頭競爭的主動權,更能夠迅速提升我國醫藥企業的綜合實力,從而實現我國醫藥產業結構的全面調整。
目前,醫藥市場較為成熟的區域主要集中在美國和歐盟,使之成為全球仿制藥廠商競爭角逐之地。然而早期,國內仿制藥企大多因認證缺失、不熟悉法規、專利意識和戰略不成熟等,未能早早抓住這場首仿爭奪戰中的機遇,因而無法贏得這場競爭潮帶來的市場紅利。如輝瑞公司研發的降血脂藥物立普妥(1iptor,通用名:阿托伐他汀)是醫藥史上第一個突破千億美元大關的重磅炸彈藥物,該藥品專利于2011年11月在美國失效。而針對其ANDA申請和專利挑戰早在2003年以后便拉開了帷幕,當立普妥的首仿競爭在美國如火如茶進行的時候,國內企業卻由于各種障礙被阻擋在游戲的門檻之外,只好眼睜睜地看著這場高回報的競爭失之交臂,實為可惜。
近年來,中國藥企把握全球大量創新藥專利到期高峰到來的戰略機遇,將眼光盯上國際市場,然而,僅個別中國藥企能在國際市場中分得一杯羹。2011年,江蘇恒瑞藥業挑戰艾普昔布美國首仿專利成功,最終取得FDA批準并上市,這是國內首例成功挑戰美國專利并贏得創新藥注射劑艾普昔布首仿的ANDA申請新藥,也開創了仿制藥企通過專利挑戰獲取首仿打入美國市場的先河。
中國藥企進行美國仿制藥特別是首仿藥申報,還是相對新的方式,且首仿藥存在較高的經濟利益預期,是值得中國藥企開展的申報方式,同時也需要企業提早進行準備,包括專利評估、分析、專利策略準備、技術準備等。
1.3 仿制藥開發的專利策略
一種藥品要上市,往往涉及多個方面,包括活性物質本身(即化合物)、化合物的制備方法、化合物的檢測方法、化合物的晶型形式、藥品的處方(即組合物)、藥品的制備方法、藥品的使用方法(即適應證)用途等;新藥原研企業往往為其品牌藥申請多個專利,將其重重保護起來。我們通常將藥品中活性成分的化合物專利稱為基礎專利(核心專利),從屬專利(外圍專利)則包括藥品活性成分的異構體、晶型、鹽類、制備方法、制劑處方、新的適應證等,甚至可能涉及特定藥物制劑形式,如特定結構形式的膠囊、異形片和不同的劑量等。
FDA的橙皮書所列藥品專利即OB專利信息對于仿制藥開發尤為關鍵。基礎專利到期日往往較早,因而也通常視為該藥品專利到期日,而從屬專利到期時間則相對較晚,有時可相差十多年。因此,在基礎專利到期較早,技術壁壘較高的情況下,企業通常優先考慮從到期較晚、易于攻破的從屬專利下手,其中主要涉及的有藥品活性物質的晶型專利、藥品具體處方的制劑專利、藥品的用藥方法專利等。
晶型專利的主要特點有:①為物質專利,能夠從實質上保護藥品。②因原研企業的研發時間早,往往保護了有利晶型,專利壁壘較高。③專利保護的晶型往往是原研藥品使用的晶型,而為了規避專利而改變晶型將使仿制藥的生物等效風險增加,晶型專利能夠增加仿制藥開發難度。
鑒于仿制藥申報和藥品上市面臨的專利障礙和相關專利的特點,通常針對仿制藥廠商面臨的晶型專利、仿制藥開發的專利策略,可從以下幾個方向考慮。
改變晶型可以相應改變晶型的結晶度、粒徑、溶出特性,進而相應改變制劑處方,在規避了晶型專利的同時可在一定程度或范圍內避開制劑專利的障礙,并且同時形成自主知識產權和產品競爭力。
其次,如果無法繞開專利保護晶型,則仿制藥廠商要上市藥物可能面臨一連串的專利侵權的風險;為了提交美國ANDA申請,需向FDA提交PIV聲明,隨后仿制藥企業將可能會面臨原研企業的訴訟,此策略耗時長、費用高,如無充分把握,代價較高,這是許多國內企業難以承受的。一旦訴訟失敗,那么仿制藥企業上市可能面臨原研公司侵權的起訴與賠償。同時,原研公司也可能會選擇與仿制藥企業達成協議的保守策略,以一種雙方利好的方式和解,近年來首仿專利挑戰以和解告終漸成趨勢。該策略是最復雜的,也是不確定性因素最高的。
如果以上方法均無法通過,那么仿制藥企業只有被動等待專利過期,這是一個漫長的過程,仿制藥廠家將喪失這段時間上市盈利的大好機會,同時面臨后期更大的市場競爭,在此過程中不排除有其他仿制藥廠家挑戰專利成功,或許可以坐收漁利。
2、羅沙司他仿制藥開發專利分析
仿制藥廠商如何規避原研藥的晶型專利,是仿制藥開發者在研發之初就需要考慮的問題。本文通過研究羅沙司他(roxadustat)晶型專利規避方法,為仿制藥研發者在研發中如何規避晶型專利提供了一種思路。其化學名為[(4-羥基一1-甲基-7-苯氧基異喹啉-3-羰基)氨基]乙酸,結構式見圖1。

羅沙司他是由美國菲布羅根公司(FibroGen)研發的一種缺氧誘導因子脯氨酰羥化酶(HIF.PH)抑制劑,其作用機制是模擬缺氧狀態,抑制HIF被羥化降解,從而激活并穩定HIF,誘導促紅細胞生成素產生,最終達到治療貧血的作用;其通過口服給藥,與傳統的輸血相比,具有更好的使用順應性;其在2017年底被國家藥品監督管理局藥品審評中心形容為“與現有治療手段相比具有明顯治療優勢”的新藥,被列為優先審評藥物,在2018年12月在中國獲得批準上市,用于治療慢性腎病或終末期腎病導致的慢性貧血;其極可能成為一個重磅炸彈級藥物,其預測銷售額可為20億美元。
羅沙司他化合物于2004年12月16日在PCT申請W02004108681中公開,申請進人了中美歐等,都保護了羅沙司他具體化合物及其鹽/酯等,是其基礎專利,到期時間至2024年6月。隨后,為了延長其藥品生命周期,在2013年原研公司申請了晶型專利W02014014834及其同族,分別在中美歐等國家/地區要求保護包括晶型A在內的多種晶型和與多種氨基酸的鹽,此晶型專利可使其藥品的保護周期從2024年延伸至2033年。仿制藥企業若不能突破此專利的限制,將不能及早上市此產品。我們本著使仿制藥盡早上市又提升自身實力的目標,對羅沙司他的中國專利規避方式方法、專利策略等進行了分析、研究和嘗試。
2.1 羅沙司他的相關專利
全面分析羅沙司他的專利,發現其存在包括化合物、晶型、工藝、制劑等多篇專利,主要專利見表1。

可以看出,原研廠商對羅沙司他化合物的保護非常重視,也很全面,有3篇專利。因此要挑戰化合物專利即無效化合物專利,難度較大且費用等成本也會較高。而其他專利申請時間較晚,到期時間也相應較遲,要及早上市仿制藥,必須無效專利或者突破專利范圍,突破技術壁壘。根據藥品領域內的已有經驗,突破晶型、工藝或制劑專利堡壘相對容易、成本相對較低且收益巨大。如果能夠突破晶型專利,則在其基礎上可以相對容易地突破工藝或制劑的專利限制。因此,突破其晶型專利對于仿制藥的提早上市有關鍵性影響。有鑒于此,全面、完整地分析晶型專利保護的情況,為制定專利策略和規避專利方法提供信息/支持和技術建議是非常有必要的。
2.2 晶型專利權范圍
分析原研Fibrogen公司在2012年7月16日遞交了優先權申請,然后在2013年7月15日遞交了國際專利申請(PCT申請),依據PCT條約進入中國,相當于在2013年7月15日向中國遞交專利申請,并且在2016年8月獲得授權公告,其歐美同族也獲得了授權。同時,其還有一些同族申請在審查過程中,見表2。

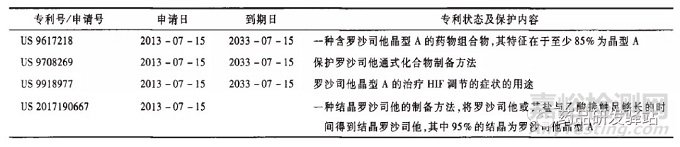
根據各專利的授權內容及同族專利申請要求保護的內容可知,原研公司想要重點保護的晶型為晶型A,同時也要求保護其他多種晶型和多種鹽,包括氨基酸的鹽,這些保護在美國獲得了授權,且美國是既保護了晶型本身,又保護了晶型的組合物;在中國和歐洲目前授權的范圍是保護了晶型A的組合物,但實質上仍然是對晶型的保護,因為沒有關于組合物組分的其他任何限定,且原研公司仍然在遞交新的分案或繼續申請仍然要求保護晶型A等晶型本身。
2.3 晶型專利審查
對比文件分析對晶型專利無效可能性進行分析,首先查閱和分析了其專利審查歷史文件。在中國和歐洲,審查時采用的對比文件基本相同,涉及對比文件D1(US 20040254215),D2(CN 201310302822.0),D3(WO 2013013609),晶型A主要相關專利及有關信息見表3。

根據晶型專利申請的審查過程看,對于新穎性申請人很容易就克服,只要給出數據認為與D1(US20040254215)中公開的化合物晶體形式不同即可克服;對于創造性質疑,申請人認為其晶型A具有較好的穩定性等也就是說具有更好的性能而具有創造性,這一觀點也被審查員予以接受,且申請人還證明對比文件D3(w0 2013013609)公開的為錯誤信息,實際上沒有公開羅沙司他晶型任何相關信息而對其申請的晶型的創造性無影響,也被審查員接受,最終獲得授權。從整個審查過程看,晶型A的創造性存在可爭議性,但仍然被答復通過。同時,根據審查過程中采用的對比文件看,對于羅沙司他晶型A,相關的現有技術較少,且還存在可能錯誤的信息,對于要無效專利來說,是一種不利的現況。
2.4 其他有關專利分析
如前所述,羅沙司他除了存在晶型專利外,還存在制劑、工藝和使用方法等專利,其中,工藝、制劑和使用方法專利都直接或間接地與晶型相關,如使用不同晶型可因晶型不同存在不同性質而采用不同處方,得到不同制劑產品,且晶型不同,則原料藥制備工藝需要調整,也會導致工藝可能與專利工藝不同;另外,原研公司保護的使用方法專利是與晶型相關。因此,如能夠規避晶型,則使用方法專利可相應規避。此外,工藝專利和部分使用方法專利與晶型專利屬于同族專利同時到期;而制劑專利是更遲遞交的申請,目前還在審查過程中,若其授權則到期時間比晶型專利更遲,如不能規避只能進行無效才能使仿制藥盡早上市,這樣對相關專利都進行無效,將面臨較多的訴訟,較高的訴訟時間成本和費用成本。
綜合上述分析和面臨的各種現況,重點考慮中國市場,同時需要兼顧美國等市場,結合申報法規,認為對晶型專利采用開發新晶型以規避專利比較適宜,這樣將來在美國即會涉及第四段聲明,側重于不侵權,既有ANDA獲得市場獨占的資格,也可以避免更多的訴訟費用等。
羅沙司他化合物專利到期相對較早,而其晶型專利到期相對較遲且與其他專利有較大關聯,規避晶型專利從而突破專利限制,有利于羅沙司他仿制藥的整體開發和各種成本控制,具有較高的實用性和可行性及經濟價值預期。
3、羅沙司他晶型專利的規避方法
為了盡早上市仿制藥,降低風險和費用成本等,綜合考慮后認為開發新晶型是一種較好的選擇,于是進行了新晶型的篩選研究工作。我們使用了多種方法,包括在多種溶劑中,不同條件下結晶,不同的滴加溶劑的方式,微波、超聲等多種條件下結晶,發現可以得到某些新晶型;但通過對新晶型的性質研究發現,所得的新晶型更易轉變為晶型A,即篩選得到的新晶型不適于開發為制劑,不具有成藥性,此種方式不可行。因此,仍然需要篩選其他晶型或者采用其他方式開發可供使用的原料形式。
我們查閱藥品領域內的專利、文獻后發現,關于復合物,固體分散體的專利申請很多,關于共晶的專利申請也有一部分,但相對其他類型顯得較少。由此產生一些想法,即是否可以開發共晶,既規避了專利又提升自我競爭力?而開發共晶是否可行和是否有法規支持,我們查閱了FDA的有關法規條款,發現FDA發布的《藥物共晶的監管分類》修訂指南草案,提供了關于共晶固態形式的監管分類等信息。FDA在指南中表示“共晶是由2種或更多不同分子,通常是藥物和共晶形成物在相同的晶格中組成的結晶物料。共晶可以根據需要用于增強藥品生物利用度和穩定性,以及在藥品制造過程中提高API的可加工性能。其第二組分是非易失性。
根據美國安全物質特別委員會數據庫(Selectcommittee on GRAs substances,sc0Gs),結合FDA相關法規、指南,認為可嘗試采用氨基酸和常用的食用酸物質,糖類物質、酰胺物質等物質作為共晶形成物。最終通過實驗,我們獲得了多種共晶,也發現了穩定存在的和溶解度比羅沙司他晶型A更好的共晶。溶解性較好,有利于藥品的溶出和體內的生物利用度,意味著具有較好的制劑可行性。
通過對專利挑戰制度、羅沙司他藥物的專利布局情況、侵權和無效可能性等的全面分析,我們選擇了規避晶型專利的策略;而通過研究藥品專利文獻和FDA法規及安全物質相關的數據庫,制定采用開發共晶的具體方式,最終結合實驗,篩選尋找到具有較好穩定性和較好溶解度性能的共晶,為制劑的開發提供了一種可能選擇。
4、結語
通過對羅沙司他相關專利的全面分析,綜合考慮專利、法規、市場、項目進展預計等因素,制定了開發新晶型規避晶型專利及其相關專利的策略;采用以常用輔料,或者某些惰性物質,或者某些具有保健作用的物質,或營養助劑,或者具有某些輔助藥物作用的物質為共晶形成物,與藥品的活性成分一起形成共晶的方式,篩選到穩定性、溶解性比現有晶型更好的共晶這種非常規的新晶型,規避了晶型專利障礙;又能夠保證藥效,甚至可以提高藥效。這種策略和方法,突破了專利限制,提升了企業自身實力,提高了產品競爭力,可以獲得較好的市場價值,為規避專利和新晶型開發提供了一種新的思路和方法;但仍然存在一些疑問有待進一步研究、解決。
羅沙司他與其他物質的共晶體,作為藥物活性成分的一種形式,在已有的上市藥物中,暫未見類似情況,因此原料藥如何控制質量標準是未知的嘗試,還需要進一步研究;共晶體藥物活性成分在藥品申請上市的行政法規審批中如何看待,仿制藥公司如何安排及安排哪些實驗提供哪些實驗數據,如何撰寫申報資料滿足法規要求都沒有明確法規規定,沒有可參考實例,如何配合法規要求還需要細致研究。

來源:Internet


