您當前的位置:檢測資訊 > 法規標準
嘉峪檢測網 2019-11-12 19:39
蔣、煜,馬玉楠,霍秀敏,馬、磊
國家食品藥品監督管理總藥品審評中心
摘要
本文結合我國發布的《化學藥品注射劑與塑料包裝材料相容性研究技術指導原則》,對如何設計提取和遷移試驗進行了闡述,重點對塑料包材中可能存在的目標化合物進行了分析。基于案例分析,討論了如何依據安全性閾值(SCT)計算化合物的分析評價閾值(AET)以及基于AET數據選擇靈敏度滿足要求的分析方法,并對提取和遷移試驗的實驗設計和結果評估進行了分析。
正文
藥品與包裝容器的相容性涉及產品安全,一直為藥品監管部門高度關注,也是藥品研發及生產企業亟待了解并進行研究的內容。與口服制劑相比,注射液或注射用混懸液等制劑,由于給藥后將直接接觸人體組織或進入血液系統,被認為是風險程度最高的品種之一。
2008年1月10日,國家食品藥品監督管理局發布了《關于發布化學藥品注射劑和多組分生化藥注射劑基本技術要求的通知》(國食藥監注〔2008〕7號),對于化學藥品注射劑,要求選取可作為注射劑包材/容器的材料,進行包材/容器相容性研究。2010年9月25日,國家局發布了《關于按CTD格式撰寫化學藥品注冊申報資料有關事項的通知》(國食藥監注〔2010〕387號),附件“化學藥品CTD格式申報資料撰寫要求”中2.3.P.2.5和3.2.P.2.5模塊是制劑與包裝相容性研究資料。上述要求均提醒藥品研發及生產企業應重視藥品與包裝的相容性研究,并在申報產品時提交研究資料。
美國FDA于1999年發布了人用藥品與生物制品包裝用容器密封系統指導原則。歐盟EMA于2005年發布了直接接觸塑料包裝材料的指導原則,主要闡述了塑料包裝材料的申報資料要求,對藥品與塑料包裝材料的相容性研究僅為一般性的描述,并無具體的試驗方法及技術要求。但上述指導原則均僅對如何開展相容性研究提出了一般性指導建議,未提供具體的試驗方法以及評價標準,難以指導國內企業開展研究。
我國食品藥品監督管理局根據國內藥物和包裝材料相容性研究的現狀,于2012年發布了《化學藥品注射劑與塑料包裝材料相容性研究技術指導原則(試行)》。我國開展此項研究的時間較短,研究基礎相對薄弱,多數企業尚未深入了解和掌握如何開展相關研究工作。
1、分析包裝材料成分
包裝容器系統包括直接包裝組件和次級包裝組件。目前在注射劑中使用的塑料包裝材料主要包括聚丙烯輸液袋、瓶;多層共擠輸液用膜制袋等。其中聚丙烯輸液瓶包含瓶和組合蓋兩部分;輸液袋通常含袋、接口、組合蓋。由于塑料輸液袋具有一定的透濕透氣性,對于某些不穩定的產品,還可能在直接接觸藥品的包裝基礎上,使用具有一定阻隔性能的外袋,即所謂內外袋組合包裝,某些產品在內外袋間還會使用吸氧劑,如氨基酸注射液等。


圖1 抗氧劑1010,168,1076,3114及其潛在的降解產物
塑料包材中可能含有未完全反應的聚合物單體,聚合物以及添加劑也可能發生降解?結合和/或反應,如SEBS中可能混有未完全反應的苯乙烯單體?
上述添加劑及其反應物或降解物等均有可能在制劑生產和貯藏過程中遷移進入藥物制劑中,在提取和遷移試驗中,需將這些成份作為評估的對象?另外,塑料包裝材料中油墨和黏合劑的成分,如異丙基苯?甲苯等也有可能滲透至制劑中?因此在提取和遷移試驗之前,需首先明確塑料包裝材料中含有哪些成份,并在此基礎上進行評估和研究?
2?計算目標化合物分析評價閾值(AET)
基于安全性閾值(SCT),以及藥物每日最大劑量?制劑包裝情況(提取試驗中使用容器的數量;與提取溶劑直接接觸的表面積;制劑生產?運輸?貯藏和使用過程中與藥液直接接觸部分的表面積等)計算每單個包裝容器中,各浸出物或可提取物的最大允許的實際濃度,計算分析評價閾值(analytical evaluation threshold ,AET)?目前,對于吸入制劑包材浸出物,推薦的SCT值為0.15μg·D-1,對于注射制劑,尚未有正式的SCT 值發布,根據與PQRI專家的討論信息,目前暫時建議采用1.5μgd-1的推薦值(該信息可能將根據ICH 等官方機構最終發布的權威信息進行修訂)?
對于濃度水平達到或超過AET值的可提取物和/或浸出物,需要對其進行鑒定,以及安全性評估?可提取物和遷移物在注射液中多為痕量水平,分析方法的靈敏度必須滿足AET 值濃度水平的測定需要?
通常情況下,揮發或半揮發有機物可選擇氣相色譜-質譜(GC-MS)法;半揮發及不揮發有機物可選擇液相色譜-質譜(LC-MS)法;無機或有機陽離子和陰離子可選擇有機酸?堿分析離子色譜(IC)法;無機元素類提取物(如微量元素和重金屬等)可選擇電感耦合等離子體原子發射光譜法(ICP-AES)?電感耦合等離子體發射光譜-質譜法(ICP-MS)?例如油墨中的甲苯可采用GC法進行測定?
對于某些大容量注射液,遷移物濃度較低難以使用常規方法進行檢測,應采用適當方式對樣品進行處理,如濃縮或者對供試溶液進行固相萃取以使其濃度滿足測定方法的靈敏度?
提取試驗主要進行方法專屬性?靈敏度等簡單的方法學驗證;遷移試驗的方法學驗證內容包括:準確度?精密度(重復性?中間精密度和重現性)?專屬性?檢測限?定量限,線性及范圍和耐用性等?
3?試驗設計
3.1?提取試驗
提取試驗的目的是預測塑料包材中可能的遷出物質?在對塑料進行測試時,通常會選擇各種性質的提取溶劑,如乙醇?異丙醇等有機溶劑,不同PH 值?極性及離子強度的水溶液?不同性質的提取溶劑獲得的可提取物不同,親脂性溶劑可提取出更多的親脂性化合物?
在對制劑進行相容性研究時,可選擇與制劑具有相同或相似理化性質的提取溶劑?如果藥液性質與塑料測試選擇的提取溶劑性質相似,也可采用其試驗結果對可提取物進行預測?通常選擇的提取溶劑包括注射用水?0.9%氯化鈉注射液?PH?3.5緩沖液?PH?8.0緩沖液?10%或15%乙醇等?
為了盡可能多的獲取可提取物信息,通常會選擇比藥物制劑滅菌?貯藏條件等更為劇烈的提取條件?例如:某注射劑采用121℃,15miN作為滅菌條件,在進行提取試驗時,可選擇121℃,60miN的提取條件?應該注意到,塑料材料可能在高溫下發生更為劇烈和復雜的降解,因此通常選擇在滅菌溫度下,延長提取試驗,以保證從包裝材料中提取出盡可能多的可提取物,但又不致使添加物過度降解以致干擾試驗?
3.2?遷移試驗
遷移試驗是考察產品在正常生產和貯藏條件下,產生浸出物的實際情況?因此在選擇試驗條件時,需要充分考慮藥品在生產?貯存?運輸及使用過程中可能面臨的最極端條件?通常選擇加速穩定性試驗以及長期穩定性試驗的條件?
如果藥物存在不同的規格或濃度,藥液與包材的接觸面積存在差異,為了測定添加物質可能發生遷移的最大程度,通常可采用藥液與包材最大接觸面積,并采用最高濃度和最低濃度藥液進行試驗?在試驗過程中,需要合理放置藥品以使其與包裝容器充分接觸?例如,將塑料袋印字一面向下放置,保證最大限度地模擬標簽或油墨成分的遷移情況?
在進行提取試驗時,應盡量避免可能干擾試驗結果的因素?例如,選擇硼硅玻璃瓶或聚四氟乙烯瓶,以及聚四氟乙烯或聚丙烯塞,或其他惰性容器進行平行對照試驗,但不宜選擇橡膠塞作為密封件?在試驗出現異常情況時,可考慮進行空白干擾試驗,以排除供試品本底干擾,避免出現假陽性結果?
4?結果評估
4.1?確定目標化合物的安全性閾值(PDE/QT)
可基于安全性數據庫,如致癌性數據庫(CPDB)?美國環境保護署(EPA)數據庫?美國毒物和疾病管理中心(ATSDR)數據庫等[6]對塑料包裝材料中可能存在的化學物質進行評估?

對于PDE數據未知的物質,如果可以獲得動物的無毒性反應劑量(NOEL)以及最低無毒性反應劑量(LOEL)數據,可參考ICHQ3C(雜質:殘留溶劑指導原則),計算得到口服給藥途徑的PDE數據?
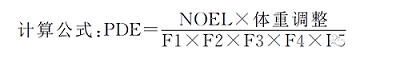

可以看出,不同數據來源,不同計算方式獲得的PDE值存在差異,建議在獲取盡可能多的毒性數據基礎上進行綜合評估,對最終確定的PDE值的合理性進行分析和評估,通常推薦使用最為敏感的嚙齒動物數據進行計算?對于未獲得毒性數據的化合物,可參考結構類似物推測其PDE值?如3,5.3-二叔丁基-4-羥基苯丙酸為抗氧劑1010和抗氧劑1076潛在的降解產物,潛在致癌性數據庫等未收載該物質相關的毒性數據?根據結構類似性,可采用兩個前體中較低的PDE值0.3mg·D-1進行安全性評估?
4.2?結果判定
建議參考《化學藥品注射劑與塑料包裝材料相容性研究技術指導原則(試行)》[2]進行試驗結果評估?
對于可獲取PDE值的目標化合物,如果可提取物的含量低于PDE,則一般認為由該可提取物導致的安全性風險小,在后續的遷移試驗可省略對該成分的研究,但仍應該在后續的遷移試驗中對該成分可能產生的降解產物或者相關產物等進行考察[7]?如果浸出物含量低于PDE時,可認為浸出物的量不會改變藥品的有效性及安全性,對患者的安全性風險小?如果浸出物的含量高于PDE時,則建議更換包裝材料?
對于PDE數據未知的物質,推薦采用兩種閾值來進行結果判定———界定閾值(QT)及安全性閾值(SCT)?對于吸入制劑,通常需對高于QT(5μg·D-1)的化合物進行安全性評估,低于QT的則只需要定性,確定不含“警惕性結構”后,不需要進一步進行安全性評估;低于SCT(0.15μg·d-1)的化合物致癌毒性和非致癌毒性的擔憂通常均可忽略不計?對于注射途徑,可以參考上述評估思路,但目前還沒有官方發布的權威數據?文獻詳細闡述了SCT,QT值的原理?來源以及適用范圍?
應當注意的是,對于某些具有特別高致癌性的物質,如黃曲霉毒素結構類似物?N-亞硝基,以及氧化偶氮基的化合物,不宜采用上述SCT值,而應采用更為嚴格的標準?
5?結語
本文對《化學藥品注射劑與塑料包裝材料相容性研究技術指導原則(試行)》中提取遷移試驗方法設計進行了解讀,初步分析了塑料包裝材料中可能存在的組分,對PDE,QT,SCT等安全性閾值在提取遷移試驗中所發揮的作用進行了闡述,對提取遷移試驗的常規方法設計和結果判斷進行了解析?我國對藥品與包材相容性研究開展時間較短,對其的認識和理解在不斷加深?值得注意的是,與此前發布的指導原則相比,新的認識對AET的計算方法有一定的修訂,并引入了QT的概念?以上信息供藥品研發和生產企業在進行藥品與包裝容器系統進行相容性研究時參考?

來源:中國新藥


