您當前的位置:檢測資訊 > 法規標準
嘉峪檢測網 2019-01-09 11:33
談到植入類醫療器械,小編相信大家或多或少都能說出幾個品類,比如骨板、骨釘、人工晶狀體、種植牙等等。因為這類產品可能會長期留在人體內,所以風險等級自然是高的。其中,保證材料的生物安全性更是重中之重。為此,廠商可以按照ISO10993-6:2016標準要求,開展植入后局部效果測試,來評估材料的生物安全性。今天,小編就帶大家一起來解讀該標準要求。
ISO 10993-6:2016標準概述
ISO 10993-6:2016明確了在植入用于醫療器械的生物材料后,評估局部效果(主要指材料的生物安全)的測試方法。該標準主要適用于三類材料:1)固體且不可吸收;2)非固體,如多孔材料、液體、膠體、糊劑和微粒;3)可降解或可吸收(固態或非固態)。
植入后局部效果測試通常會使用大鼠、豚鼠、兔子等動物作為試驗模型,所以第一個基本考慮就是動物福利,測試要滿足ISO 10993-2標準要求。其次,要考慮的是樣本制備,因為樣本的理化性質(如形狀、密度、硬度、表面加工等等)會直接影響組織對測試材料的生物學反應,所以樣本制備過程必須符合ISO 10993-12要求。最后一個基本考慮是試驗設計,植入測試一般都會設置對照組,那么對照品的物理特性一定要和測試樣本盡可能接近,并且有足夠的文獻資料證明其材料的生物安全性。特別要注意的是,如果器械包含兩種或以上的材料,那測試樣品也必須具有相似的成分,或者可能需要多個植入物。
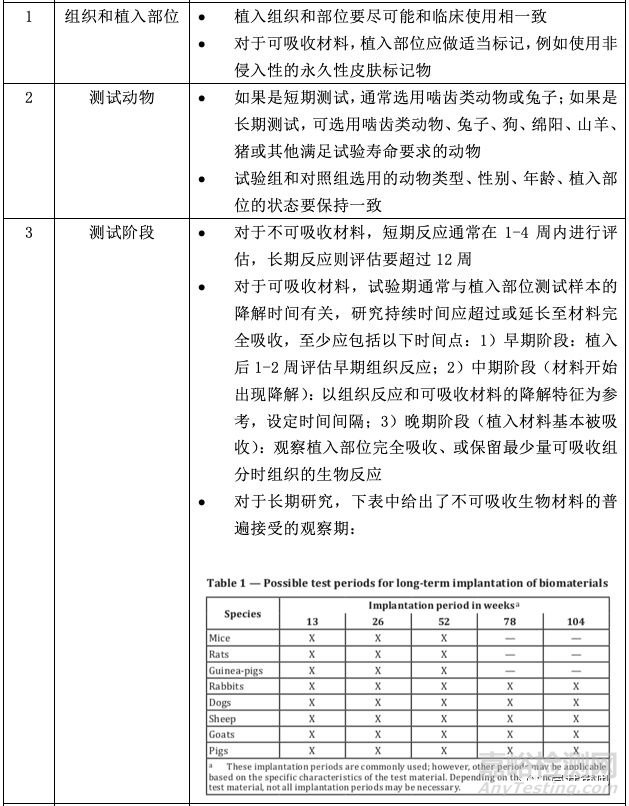
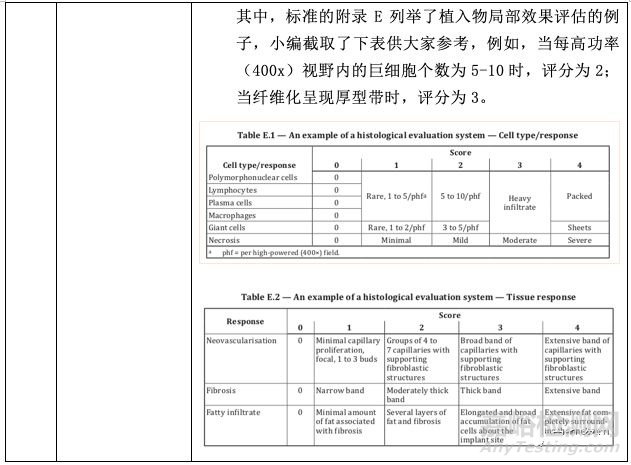
關于測試方法,小編將標準內容做了整理總結,并從以下五個方面跟大家做介紹。若涉及具體的試驗設計,大家可參考標準的附錄A-D。
測試報告
按照ISO 10993-6:2016標準要求,植入后局部效果測試報告應至少包括以下內容:
參考資料:
[1] ISO 10993-6:2016 Biological evaluation of medical devices -- Part 6: Tests for local effects after implantation



來源:啟升資訊


