近日,MDCG對MDCG 2024-14 關于實施隱形眼鏡主UDI-DI解決方案的指南進行了更新,更新內容如下:
1.引言及范圍
MDR Art.27中提到UDI系統的引入旨在確保醫療器械具有足夠水平的識別和可追溯性。制造商在將除定制器械外的所有器械投放市場前須為其分配基本UDI-DI、UDI-DI以及UDI-PI,并在Eudamed中注冊基本UDI-DI和UDI-DI。對于呈現高度個性化水平的隱形眼鏡(高度個性化器械),MDR Annex VI C部分第6.6.1節規定了主UDI-DI的分配(分別由EU 2023/2197、EU2025/788進行了兩輪修訂)。
本指南就隱形眼鏡主UDI-DI規則的結構、分配、標簽和在Eudamed中的注冊實施提供指導。
2術語
標準隱形眼鏡(包括標準軟性隱形眼鏡和硬性透氣性(RGP)隱形眼鏡):即批量生產的隱形眼鏡,通常由制造商/分銷商/眼科護理專業人員持有庫存,且參數范圍有限。例如:標準軟性日拋型隱形眼鏡。
定制式隱形眼鏡(軟性或硬性):根據特定個人訂單進行生產,鏡片具有廣泛的參數范圍。例如:車床切割的按訂單生產的季拋鏡片。
隱形眼鏡設計參數:用于向使用者、眼科護理專業人員以及其他利益相關者標識臨床尺寸的隱形眼鏡參數。例如:基弧、直徑、加光度、軸位……
基本UDI-DI:用于連接具有相同預期用途、風險等級、基本設計和制造特性的器械的標識符。對于隱形眼鏡,觸發基本UDI-DI分配的參數可包括如材料、濾光片、著色、鏡片類型等。
主UDI-DI:用于針對某些高度個性化器械進行分組的唯一標識符。此類高度個性化器械在預定義的臨床相關參數方面具有特定的相似性,例如:應為具有相同隱形眼鏡設計參數組合(至少包括基弧和直徑)的隱形眼鏡分配的單一的主UDI-DI。主UDI-DI應與一個基本UDI-DI相關聯。
UDI-PI:包括序列號、批號、軟件標識以及生產日期或有效期或兩種日期,適用于隱形眼鏡。
3主UDI-DI
由于隱形眼鏡具有眾多臨床參數特征,存在多種變體。若根據MDR要求,為每種隱形眼鏡變體都分配獨立的UDI-DI,則會導致在UDI-DI層面的個體化分配導致相似隱形眼鏡的UDI-DI數量激增,不僅使Eudamed超負荷運行,也與隱形眼鏡相關的安全風險程度不成比例。因此,歐盟醫療器械主管機構根據當前技術表明:將具有相同臨床和設計參數組合的隱形眼鏡歸組到同一UDI-DI(主UDI-DI)下。以下為示例圖:
同時,對向隱形眼鏡和其他器械分配UDI-DI所提供的不同器械標識符和標識級別進行比較:
標準隱形眼鏡主UDI-DI分配
標準隱形眼鏡的主UDI-DI將分配給制造商定義的特定隱形眼鏡設計參數組合,至少包括基弧和直徑,并輔以標簽上向最終用戶、眼科護理專業人員等指明的其他相關參數。示例:當一種鏡片以一種材料提供,并有球面、復曲面、多焦點設計變體時,它將由三個基本UDI-DI(一種材料+設計類型)和相應數量的主UDI-DI覆蓋,如下圖:
UDI-PI:不需要為標準隱形眼鏡分配特定的PI,MDR Annex VI Part C關于PI的規定適用。
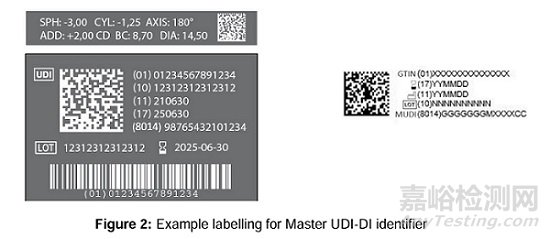
標簽:MDR Annex VI Part C section 4中關于UDI載體的規則適用于主UDI-DI。以下標識是基于GS1發行機構的主UDI-DI標準的一個標簽示例,反映了自動識別和數據采集(AIDC)和人工可讀信息(HRI)載體可與其他信息和條碼結合,以滿足MDR中規定的要求。
UDI載體(包括主UDI-DI)在隱形眼鏡包裝上的放置取決于MDR中的規定和要求,尤其要滿足空間限制和銷售單位的要求。隱形眼鏡泡罩包裝的標簽要求取決于空間限制以及根據MDR要求被視為最終用戶使用的最低包裝層級。如果根據MDR,隱形眼鏡泡罩包裝被視為最終用戶使用的最低包裝層級,則主UDI-DI可以為一條5片的隱形眼鏡泡罩帶標注一次,前提是制造商已進行了相關的風險管理。
定制式隱形眼鏡主UDI-DI分配
主UDI-DI將根據制造商定義的隱形眼鏡設計參數組合并結合其他相關參數分配給按訂單生產的隱形眼鏡,應考慮其高度個性化和定制化的特點,示例如下:
UDI-PI:應使用唯一的批號/序列號作為按訂單生產隱形眼鏡的UDI-PI。
標簽:MDR Annex VI Part C section 4中關于UDI載體的規則同樣適用于定制式隱形眼鏡的主UDI-DI。以下是基于GS1和HIBCC發行機構的主UDI-DI標準的示例:
4不同包裝層級的主UDI-DI分配
主UDI-DI可以與具有相同隱形眼鏡設計參數組合的分組相關聯,無論包裝尺寸如何,該分組將包括識別該分組中的所有使用單位、包裝尺寸和更高層級的包裝。包裝尺寸本身不影響關鍵設計參數。參照UDI-DI的分配,若存在更高層級的包裝,則更高層級的包裝應被分配主UDI-DI,運輸包裝不分配主UDI-DI。
5警戒報告
對于符合MDR的隱形眼鏡進行警戒報告時,制造商應提供完整的UDI(主UDI-DI+UDI-PI),以便在發生不良事件時可準確追溯器械。對于遺留隱形眼鏡進行警戒報告時,可通過Eudamed ID或UDI-DI(如GTIN)結合UDI-PI來識別,以便在Eudamed中進行警戒報告。
6主UDI-DI實施時間表
EU 2023/2197關于隱形眼鏡的主UDI-DI于2023年10月20日發布,從2023年11月9日生效;EU 2025/788關于適用日期修訂為2026年11月9日,提供了三年的過渡期,過渡期結束后才對隱形眼鏡強制分配主UDI-DI。但在過渡期間,制造商可以自愿進行主UDI-DI分配。
7Eudamed中的器械注冊
對于隱形眼鏡,當選擇特殊器械類型“標準軟性隱形眼鏡”或“硬性透氣性隱形眼鏡”或“定制式軟性隱形眼鏡”或“定制式硬性透氣性隱形眼鏡”時,主UDI-DI將在Eudamed中注冊并代替UDI-DI使用。遺留隱形眼鏡不應在Eudamed中注冊,除非需要采取警戒行動。
參考資料:MDCG 2024-14 Rev.1 Guidance on Master UDI-DI for contact lenses