您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2025-06-12 20:19
溶出數據顯示,擬定的omaveloxolone膠囊,50毫克,在擬定溶出介質(即50 mol磷酸鈉緩沖液中,pH值6.8,%1的SLS)中45min實現完全溶解。
2)溶出方法區分力
a)原料藥粒徑分布(PSD)的變化
申請人通過有意生產具有不同PSD原料藥批次的制劑,研究了溶出方法對原料藥粒度改變的區分力,如表6所示。溶出結果如圖4所示,表明擬定溶出方法無區分PSD變化的能力。
表6: 無定型原料藥變異PSD溶出區分力研究

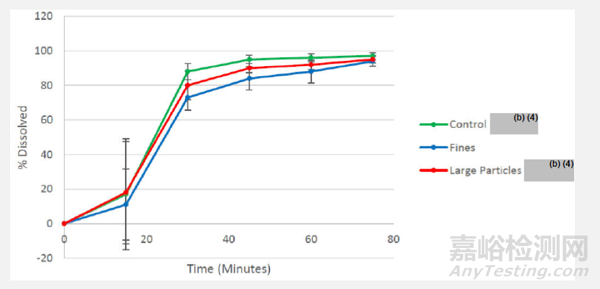
圖4 Omaveloxolone膠囊的平均溶出曲線(N=18),50mg,無定型原料藥粒度變化,在%1SLS的pH 6.8磷酸鹽緩沖鹽,100rpm轉速
FDA審評:
Omaveloxolone是一種BCS IV類藥物,具有中/高生物藥劑學風險。FDA期望擬定溶出方法對關鍵物料屬性(CMAs)和關鍵工藝參數(CPPs)具有一定的區分能力。期望該方法能夠區分原料藥PSD變化。然而,在上述研究中,擬定溶出方法并沒有區分原料藥粒徑分布(PSD)變化。原因可能是三批次原料藥之間的PSD差異不顯著。在生物藥劑學問詢中,FDA進一步要求企業研究擬定溶出方法是否能區分原料藥PSD的更大差異。
企業在回復FDA問詢時闡述到,實際生產中,很難得到有巨大差異PSD的原料藥,同時企業也同意修改原料藥PSD接受標準,對D90限度進行修改,從NMT XXum 修改至NMT XXum。
c)處方變化
企業通過改變輔料的比例來特意生產以下批次,如表7. 對于這些批次,擬定的溶出方法沒有展示出區分力,數據如圖5.
表7:改變處方組成

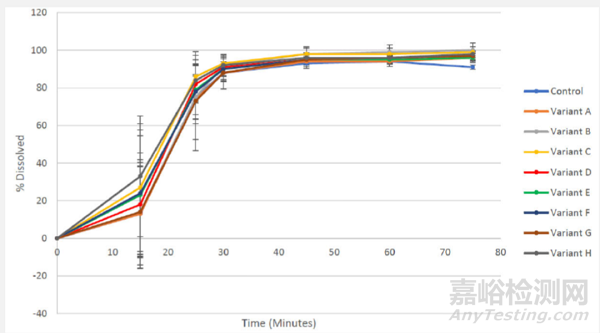
圖5: Omaveloxolone 膠囊50mg規格平均溶解曲線(N=12),處方比例變化, 在1% SLS磷酸鹽緩沖液pH 6.8,100 rpm轉速
FDA審評意見:
由于原料藥生產過程限制,企業無法得到在PSD上差異很大的不同批次制劑,以進一步研究擬定溶出方法的區分力。然而,擬定溶出方法的區分力(b)(4)當溶出接受標準為Q"= XX% XXmin" 修訂為 Q"= XX% 45 min時,帶有(b)(4)的批次將被拒絕,這將進一步減輕生物藥劑學風險。總體而言,擬定溶出方法被認為是可以接受的。
2.溶出數據和接受標準
a)溶出數據
企業提供了10個臨床批次和3個注冊批次的詳細信息和完整的溶出曲線數據(表8和表9)。
發現幾乎所有溶出數據為6粒/批,而不是FDA要求的12粒/批的溶出數據。而且,不同批次有不同的取樣時間點(比如,批170114的取樣時間點:10,15,20,30,45,60min;批318136R的取樣時間點:15,30,45,60min),這樣的數據導致很難對比批間的溶出差異。企業對于生物藥劑學IR1的回復,提供的數據見表10.
表8:所有臨床批次和注冊批次表

9:所有注冊批次表

10:關鍵臨床批次和注冊批次平均溶出曲線數據(n=12)

【解讀】
對于具有BCS IV類特征的化合物,其具有中高生物藥劑學風險,即溶出是否可以識別出那些不合格的批次樣品。這些不合格的樣品可能是不同工藝,或者不同CQA原料藥生產得到的。FDA挑戰了方法對原料藥粒度的區分能力,但可惜的是,通過生產不同粒度原料藥得到的制劑,溶出曲線沒有表現出差異,即溶出方法對原料藥粒度變化沒有區分力。
企業通過變化處方中不同輔料比例得到的批次,擬定的溶出方法測試數據與不同粒度原料藥一樣,沒有顯示方法的區分力。FDA的審評意見中,可以看出溶出方法對某一參數或因素的變化,可以表現出區分力,通過修訂Q值時間,區分出這些參數/因素變化的批次。
即使是BCS IV類化合物,擬定的溶出方法沒有在原料藥粒度或處方組成上表現出區分力,FDA在審評過程中提出了一些問詢,但沒有否定該溶出方法,而是希望企業提供更多的研究數據說明,以及體內的PK數據說明,擬定方法可以用于批次質量放行。
FDA指出企業提供的不同批次溶出數據有一些瑕疵,即取樣時間點各有不同,無法進行批次之間的溶出曲線對比,這些批次中有用于確證性臨床的,其溶出數據的對比對于溶出方法的擬定和接受標準擬定非常關鍵。

來源:蒲公英Ouryao


