|
NDA序號
|
216718
|
|
申請人
|
Reata Pharmaceuticals
|
|
產(chǎn)品名
|
SKYCLARIS (擬定專有名) omaveloxolone 膠囊
|
|
劑型
|
膠囊
|
|
規(guī)格
|
50mg
|
|
使用途徑
|
口服
|
|
日最大劑量
|
150mg
|
|
Rx/OTC
|
原研
|
|
適應(yīng)癥
|
治療16歲及以上成人和青少年的Friedreich’s 共濟(jì)失調(diào)癥。
|
|
制劑描述
|
不透明的硬HPMC膠囊,帶有淺綠色膠囊殼和藍(lán)色蓋子,膠囊殼印有“RTA 408”,膠囊蓋白色墨水印有“50”。
|
|
儲存條件
|
20°C - 25°C
|
溶出變異
批內(nèi)變異
表11: 3期臨床注冊批次(Omaveloxolone膠囊,50mg)的變異性對比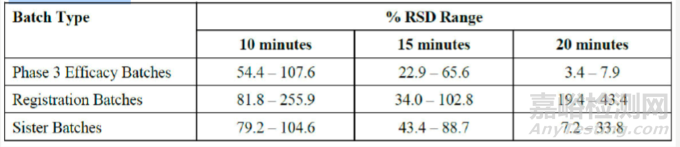
由于批內(nèi)變異性高,F(xiàn)DA要求企業(yè)提供理由,并提供足夠支持性數(shù)據(jù),證明擬定的溶出方法適用于該制劑。企業(yè)在回復(fù)FDA的問詢時,企業(yè)調(diào)查了變異性的根本原因,并得出結(jié)論,早期取樣時間點的較高變異性是由于HPMC膠囊殼在解體/破裂時間上的變異性。企業(yè)比較了HPMC和明膠膠囊的破裂時間,發(fā)現(xiàn)HPMC膠囊通常有延遲破裂。
為了進(jìn)一步支持omaveloxolone膠囊溶出延遲變異性原因與HPMC膠囊殼的破裂相關(guān),企業(yè)比較了帶膠囊殼和不帶膠囊殼的三批樣品溶出曲線特征。如圖6所示,不帶膠囊殼的內(nèi)容物溶出時,omaveloxolone 溶出迅速,與完整帶有膠囊的樣品相比,變異性要低得多,這表明膠囊殼是單個膠囊結(jié)果在早期時間點變異性的原因,如寬變異性記錄,特別是在10分鐘和15分鐘。
圖6: Omaveloxolone 膠囊,50mg,批3173957R,完整帶膠囊殼與不帶膠囊殼的樣品溶出
盡管觀察到了批次內(nèi)高變異性,但企業(yè)認(rèn)為這種變異性不太可能 omaveloxolone膠囊的體內(nèi)藥代動力學(xué)產(chǎn)生任何影響,因為它是一種BCS IV類化合物,其吸收不受胃排空的顯著影響。
FDA同意企業(yè)觀點,即觀察到的高變異性來自HPMC膠囊的可變的破裂時間。FDA認(rèn)同,與明膠膠囊相比,HPMC膠囊往往有延遲破裂。然而,企業(yè)對HPMC膠囊具有如此高溶解變異性的釋釋最初沒有令FDA滿意。可能是HPMC膠囊均一性不好,因此在崩裂時造成了高變異性。從生物藥劑學(xué)角度看,這可能是一個質(zhì)量問題。FDA在審評周期內(nèi)向制劑的審評團(tuán)隊傳達(dá)了這一擔(dān)憂。
如表12所示,PK參數(shù)的變異性超過35%。食物對Cmax和Tmax向左移動(從1小時到5小時)有顯著影響,這表明食物通過增加其滲透性顯著促進(jìn)了omaveloxolone的吸收。食物效應(yīng)研究結(jié)果證實,omaveloxolone的滲透性低。由于數(shù)據(jù)不足,并且該制劑缺乏既定的IVIVC(體外體內(nèi)相關(guān)性),觀察到的高批次間溶出變異性對omaveloxolone的PK參數(shù)潛在影響無法定量預(yù)測。然而,omaveloxolone是一種BCS IV類藥物,溶解度低,滲透率低。溶出不是口服吸收速率的限制步驟。考慮到所有制劑粒數(shù)在45分鐘內(nèi)實現(xiàn)了接近完全的藥物釋放,Tmax約為1小時,以及原料藥的BCS分類,F(xiàn)DA認(rèn)為,批次內(nèi)溶出高變異性不太可能對omaveloxolone的體內(nèi)藥代動力學(xué)產(chǎn)生任何顯著影響。因此,F(xiàn)DA從生物藥劑學(xué)角度認(rèn)為,高溶出變異性不是一個制劑是否批準(zhǔn)的影響因素。擬定制劑的臨床有效性可接受結(jié)果將支持制劑的批準(zhǔn)。
表12: 血漿omaveloxolone藥代動力學(xué)參數(shù)和藥代動力學(xué)人群小結(jié)(研究408-C-170)
批間也觀察到早期取樣時間點的高變異性。特別是,三個注冊批次(批次3173381R、3173382R、3173383R)的溶出曲線與四批臨床3期樣品(批次160033、170103、170114和3173957R)的溶出曲線明顯不同,如圖7所示。
圖7: omaveloxolone膠囊,50毫克,注冊和臨床3期批次溶出放行結(jié)果(n=6)
圖8: omaveloxolone膠囊,50毫克,注冊和臨床3期批次溶出放行結(jié)果(n=12)

由于原始提交的注冊批次和臨床批次取樣時間點不同,因此不宜比較其溶出曲線的相似性。
根據(jù)要求,企業(yè)對上述批次重復(fù)測試了溶出,并生成具有相同取樣時間點的數(shù)據(jù),如圖8所示。計算出的相似性因子(f2 <50)表明,注冊批次的溶出速率明顯低于臨床批次。
由于注冊和臨床批次之間的上述顯著差異和溶出曲線特點,企業(yè)被要求提供理由,包括PBBM模型的任何信息,或體內(nèi)數(shù)據(jù)信息,確認(rèn)溶出曲線的顯著差異是否會導(dǎo)致體內(nèi)有效性差異。
在IR的回復(fù)中,企業(yè)表示即使這些批次有不同的溶出曲線,三批膠囊內(nèi)容物的溶出是相似的,這表明omaveloxolone通常在前10分鐘內(nèi)釋放80-90%(圖9)。為評估溶出變異性對體內(nèi)有效性的影響,企業(yè)評估了omaveloxolone的藥代動力學(xué)特征。由于藥物吸收速度緩慢,并在11小時(范圍為3至24小時)達(dá)到最大濃度(Tmax),企業(yè)總結(jié)溶出曲線在早期時間點的變異性預(yù)計不會對omaveloxolone的Tmax產(chǎn)生影響。因此,企業(yè)認(rèn)為溶出曲線的早期時間點(10-20分鐘)的變異性將對omaveloxolone的總生物利用度有很小或沒有影響。
而且,企業(yè)正在與(b)(4)建立合作,在禁食條件下研發(fā)其體外/體內(nèi)相關(guān)性(IVIVR),并通過傳統(tǒng)或建模方法(PBBM)建立安全空間。值得注意的是,企業(yè)還沒有提供后續(xù)信息。
圖9:批次160033, 3173381R, and 3173857R膠囊內(nèi)容物的溶出曲線對比

FDA進(jìn)一步查看了數(shù)據(jù),發(fā)現(xiàn)(b)(4)中生產(chǎn)的膠囊批次藥物釋放速度往往更快,而(b)(4)中生產(chǎn)的膠囊批次藥物釋放速度較慢(表10)。這一發(fā)現(xiàn)進(jìn)一步證實,從圖9中類似的溶出特點和膠囊內(nèi)容物的微小變異性來看,溶出變異性來自膠囊破裂時間的變異性,因為這些HPMC膠囊在不同生產(chǎn)地點之間不均勻。
表13: 不同生產(chǎn)場地的膠囊殼應(yīng)用于臨床和注冊批次信息總結(jié)
值得注意的是,評估體外溶出如何影響omaveloxolone體內(nèi)PK的信息有限。只有一批(批次3169638R)用于PK研究。此外,尚未為該制劑建立IVIVC,無法確認(rèn)溶出較慢的注冊批次會導(dǎo)致比臨床批次更低的生物利用度。盡管來自三個不同批次膠囊內(nèi)容物表現(xiàn)出相似的溶出特點(圖9),但不能排除由HPMC膠囊引起的不同溶出特點對omaveloxolone的體內(nèi)有效性產(chǎn)生影響的可能性。在回復(fù)FDA的問詢中,企業(yè)提到他們正在使用PBBM建模和模擬來解決這個問題。
關(guān)鍵臨床研究中使用的超過4批次膠囊表現(xiàn)出不同的溶出特點,其中少數(shù)明顯不同。FDA審評員向企業(yè)醫(yī)學(xué)官傳達(dá)了高溶出變異性問題并詢問了是否會由于批次內(nèi)和批次間變異性高而觀察到顯著不同有效性和安全性特征,以及是否可以進(jìn)行任何基于批次的子組分析。
企業(yè)醫(yī)學(xué)官解釋到,觀察到了可變療效終點(mFARS)。然而無法得出結(jié)論,療效或安全終點的變異性是否可以歸因于體外溶出變異性。FDA與企業(yè)進(jìn)行了會議討論,結(jié)論是根據(jù)目前有限的體內(nèi)數(shù)據(jù),很難預(yù)測觀察到的高批次內(nèi)和批次間變異性如何影響擬定制劑的PK。盡管這仍是FDA審評員的擔(dān)憂,但臨床結(jié)果決定其可得到批準(zhǔn)。企業(yè)擬定溶出接受標(biāo)準(zhǔn):Q=(b)(4)在(b)(4)min。
表10顯示,除批次3165601R外,所有臨床/注冊批次在45分鐘內(nèi)平均溶出至少為87%,這表明擬定的溶出接受標(biāo)準(zhǔn)為(b)(4),如下:Q= (b)(4) 在45 min。溶出方法區(qū)分力研究表明其支持監(jiān)管決定,設(shè)定溶出標(biāo)準(zhǔn)Q= (b)(4) 在45 min可以用于拒絕某類批次(見圖5)。如企業(yè)對FDA的問詢回復(fù)所示,企業(yè)接受了FDA的溶出接受標(biāo)準(zhǔn)建議。
如表8所示,臨床批次3187136R、3173957R、3169638R、3165601R和3164723R在(b)(4)制造。所有其他批次均在(b)(4)中生產(chǎn)。
表14 不同場地生產(chǎn)批次的平均溶出數(shù)據(jù)比較

圖10 不同場地生產(chǎn)批次的溶出曲線比較
表15 在不同場地生產(chǎn)批次之間的相似性
FDA審評,表15中計算的相似性系數(shù)表明,除了批次3173957R與批次170103外,在不同場地生產(chǎn)的批次并不相似。請注意,上述所有批次都有用于有效性研究。臨床數(shù)據(jù)將為橋接提供進(jìn)一步的支持。
審評中發(fā)現(xiàn)omaveloxolone膠囊相同批次內(nèi)的溶出,在前15分鐘變異非常大,F(xiàn)DA要求企業(yè)提供理由。企業(yè)調(diào)查研究的原因是膠囊殼在溶出前15分鐘的破裂速度有快慢,從而導(dǎo)致批內(nèi)溶出在前15分鐘的高變異性。企業(yè)也對比了不使用膠囊殼的內(nèi)容物溶出,批次之間的速率非常快,不存在變異。化合物的PK數(shù)據(jù)顯示,Tmax為1小時,膠囊的完全溶出時間在45分鐘,說明溶出的早期變異性并不影響膠囊在體內(nèi)的表現(xiàn),批次內(nèi)溶出高變異性不太可能對omaveloxolone的體內(nèi)藥代動力學(xué)產(chǎn)生顯著影響。同樣的情形也發(fā)生在omaveloxolone膠囊批次之間。不同批次溶出在前15分鐘存在高變異性,f2因子對比大部小于50%。原因也是不同批次制劑使用的HPMC膠囊導(dǎo)致,同時HPMC膠囊不同批次之間也存在崩解的差異性。但這些早期時間點溶出高變異性并不影響體內(nèi)的溶解,因為制劑在體人的Tmax 在3-24小時,前15分鐘溶解的變異性不足以對體內(nèi)產(chǎn)生根本性影響。由于批間和批內(nèi)溶出的高變異,F(xiàn)DA表示了擔(dān)憂,并與企業(yè)醫(yī)學(xué)負(fù)責(zé)人進(jìn)行了會議溝通。但omaveloxolone膠囊在臨床上表現(xiàn)出的安全性和有效性良好,藥學(xué)的變異性不影響其最后的批準(zhǔn)。FDA最后也沒有要求企業(yè)進(jìn)行膠囊殼成分的變更,或者溶出方法的重新開發(fā),說明新藥在FDA得到批準(zhǔn),臨床數(shù)據(jù)的表現(xiàn)會起到關(guān)鍵的作用。














