您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2024-07-26 14:03
前言
在過去的十年里,血流導向裝置(FDs)已成為治療顱內動脈瘤的標準血管內手術方法。FDs已經在臨床中展現出卓越的安全性和動脈瘤閉塞率。因此,一些FDs已獲得市場批準,還有更多的器械正在研發中。雖然FDs的臨床性能特征對臨床醫生來說已經很熟悉,但對工程師如何實現成功的器械性能卻了解較少。本文將概述工程師可用的基本FD設計參數,并描述對于實踐中的介入醫生而言,它們的選擇如何影響器械性能的特性。
理想的FD
”血流導向裝置“這個通用術語描述了覆蓋動脈瘤/載瘤動脈交界的裝置,以實現動脈瘤閉塞。在放置后最初階段,該裝置可能會導致一定程度的血流“轉移”到載瘤動脈中,這些血流原本可能會進入動脈瘤,而且這個術語本身并不具體,可能并不比”擾流“等術語更有效。
然而,隨著時間的推移,組織將會生長在動脈瘤頸部,動脈瘤將會閉塞,最終的目標是將所有的血流都從動脈瘤囊中轉移開。此外,現在有腔內和囊內兩種血流導向裝置;本文將專注于前者類型。
一般來說,血流導向裝置(FDs)是編織或織造的支架,釋放至動脈瘤頸部處的載瘤動脈中。這些裝置的目的是轉移大部分流經動脈瘤的血液,導致動脈瘤內血液停滯并凝結。這種血流轉移導致的動脈瘤內血液滯留在理論上形成了動脈瘤腔內的血栓栓塞,阻礙了血流進入動脈瘤。同時,該裝置作為內皮化和新內膜生長在動脈瘤頸部的腳手架,最終將動脈瘤從血流中閉塞。總的來說,理想的FD最大程度地簡化了植入過程和提高動脈瘤閉塞,同時最小化并發癥的風險。
多個相互關聯的FD性能特征有助于臨床療效。理想的FD最大程度地促進動脈瘤囊內的血液滯留,同時促進動脈瘤頸部的快速內皮化和新內膜生長。主要設計目標簡要列舉如下,然后在下文中詳細討論與設計選擇相關的工程原理。首先,FD與載瘤動脈的完美貼壁在釋放后有利于囊內血液滯留和內皮化。此外,FD的緊密貼壁可以減少裝置編織絲與動脈壁之間形成血栓的風險,但這可能導致穿支動脈的堵塞和狹窄。提高裝置的靈活性和在某些情況下增加裝置的徑向張開力(或慢性外擴力)可以實現更好的貼壁。在筆直的血管中,增加張開力理論上會將編織絲更緊貼在血管壁上。然而,在迂曲的解剖結構中,裝置的靈活性可能比徑向張開力更有利于保持貼壁。因此,貼壁最終是多種因素的結果。其次,理想的FD最小化了在腔內引起血栓栓塞或鄰近動脈瘤處穿支動脈閉塞等并發癥的風險。第三,理想的FD簡化了介入醫生的操作釋放過程。
可以通過較小內徑(ID)微導管釋放的FD對于推送微導管穿過迂曲的腦血管系統是有優勢的,并且可能允許將其推送至更遠處的動脈瘤。目前FD輸送微導管的基準內徑為0.027英寸,理想的FD應該可以通過這個尺寸或更小的微導管進行輸送釋放。減少輸送力(我們定義為推送FD通過微導管腔道所需的力)也有助于簡化介入醫生的操作輸送過程。理想的FD應該盡可能輕松地實現適當的貼壁。最后,FD需要具有適當的可視性,以便在透視引導下進行輸送,而不會影響其MR成像安全性或誘導過多的CT或MR成像偽影,這可能會妨礙無創隨訪成像。
FD設計參數
通常情況下,血流導向裝置(FDs)是通過在芯軸周圍編織一組36-96根金屬絲,并對其進行熱處理以鎖定形狀而制成的。然后移除芯軸,留下金屬網狀管,再將其切割成所需長度。器械隨后可能會進一步加工,包括固定松散的金屬絲端部、添加放射性顯影標記,或處理器械表面。最后,將器械裝入其輸送系統中。盡管FDs的總體構造在概念上很簡單,但涉及許多設計參數,包括金屬絲直徑、編織中的金屬絲數量、金屬絲材料的選擇等,所有這些都會影響器械性能。選擇其中一個設計參數可能會對FD的一個性能特征產生積極影響,同時對另一個性能特征產生負面影響。FD工程師的任務是選擇參數,找到一個平衡點,以優化介入醫生認為最重要的性能特征。FD設計參數與性能影響之間的關系總結在圖1中。
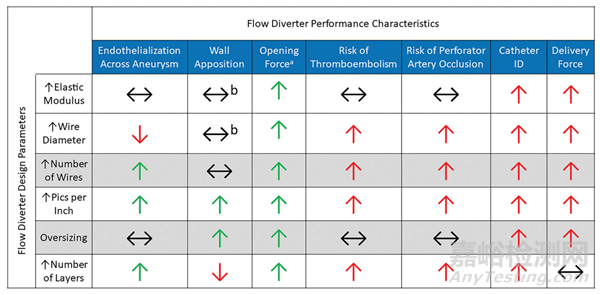
圖1. FD設計參數與結果性能特征之間的關系。綠色和紅色箭頭分別表示在器械性能和安全性方面的有益或有害關系。黑色水平箭頭表示設計參數與性能特征之間的獨立或多因素關系。A,優化的張開力假設編織的金屬絲在被壓縮到微導管后不會發生塑性變形,從而實現器械完全再擴張。B,貼壁是復雜的,取決于許多變量,包括載瘤血管的迂曲程度。
FD編織幾何構造
工程師可以調整許多FD編織幾何設計參數。首先是編織內單根金屬絲的直徑。增加金屬絲直徑會增加器械的整體強度,提高張開力和徑向抗壓能力。然而,這種改善的張開力是以增加輸送力為代價的,并且可能需要更大的微導管內徑進行輸送。較大的金屬絲直徑可能與延遲的內皮化以及血栓栓塞的風險相關,就像較大的冠狀支架支柱一樣。然而,這種關系在FD應用中尚未得到廣泛研究。市場批準的FD通常具有約18-35μm(約0.0007-0.001英寸)范圍內的金屬絲直徑。
另一個設計參數是編織內的金屬絲數量。與金屬絲直徑類似,增加編織內的金屬絲數量將增加FD的張開力,但會增加輸送力,可能需要更大的微導管內徑。例如,Pipeline Vantage(Medtronic)較大直徑的產品包含64根金屬絲,通過0.027英寸內徑微導管釋放,而較小直徑的產品包含48根金屬絲,可以通過0.021英寸內徑微導管釋放。在編織內增加更多金屬絲已被證明有助于促進動脈瘤頸部的內皮化。然而,更多的金屬絲也可能與更大的穿支動脈閉塞風險和血栓栓塞相關。市場批準的FD通常包含48-64根金屬絲。另一個類似的FD設計參數是pics-per-inch(PPI),它定義為沿器械長度每英寸的金屬絲交叉目數。通過增加編織內的金屬絲數量可以增加PPI,也可以通過改變編織金屬絲的角度來調整,如圖2所示。當從縱向視圖觀察FD時,如果將編織角定義為金屬絲與支架軸線之間的角度(如圖2所定義),增加編織角度會增加PPI。更高的PPI會導致FD具有更大的張開力,并可以改善器械順應性,最終實現更好的貼壁。然而,與增加PPI相關的金屬絲密度增加可能也會增加輸送力,并需要更大內徑的微導管。與增加編織內的金屬絲數量類似,更高的PPI有助于動脈瘤閉塞和動脈瘤頸部的內皮化,但可能增加穿支動脈閉塞和血栓栓塞的風險。

圖2. 纖維角度(由紅色θ定義)與金屬絲或PPI以及孔密度之間的關系的圖示。
FD的oversize是在選擇器械時介入醫生可以考慮的另一個設計參數或選項。器械可能被構造成其公稱直徑(由編織金屬絲的芯軸直徑決定)大于其預期載瘤動脈直徑。最初,oversize的動機是為了提高貼壁和張開力。然而,體外流體動力學研究表明,oversize會導致器械幾何形狀的改變,如金屬絲之間的角度或網孔大小,從而導致動脈瘤囊內的血流增加。因此,oversize與臨床上較低的動脈瘤閉塞率相關。在選擇FD尺寸時還需要考慮器械的縮短問題。在徑向方向上過度擴張的FD將最終變得更短。相反,當在比器械直徑小得多的動脈中釋放時,FD將比預期更長。
在構建FD時,也可以使用多層金屬絲編織。理論上增加層數會增加張開力,但可能需要更大的微導管內徑。增加層數的主要動機是通過在動脈瘤頸上沉積更多的金屬絲來“人為”增加PPI,并由此提高血流導向功能。多層可能導致動脈瘤囊內的血液滯留增加,以及器械和動脈瘤頸上更快的組織生長。然而,堆疊的金屬絲會增加它們載瘤血管的內腔的延伸,加劇血栓栓塞的風險,以及金屬絲與動脈壁貼合后內皮化的速率。此外,額外的層數可能會導致層間位移或者通過額外的裝置釋放對內皮細胞造成更多的破壞。Flow-Redirection Endoluminal Device (FRED)(MicroVention)具有獨特設計,外部采用較大的金屬絲編織,類似于LVIS支架(MicroVention),內部采用編織FD。相關的是,使用多個單層裝置在動脈瘤頸部套疊式釋放也被證明增加血栓栓塞并發癥的發生率。
孔隙度、孔密度和金屬覆蓋率是經典的FD指標,最終是其選定的設計參數的結果。孔隙度定義為器械壁面未被金屬絲覆蓋的百分比區域。相反,金屬覆蓋率定義為器械壁面被金屬絲覆蓋的百分比區域;兩者不夠具體,因為更粗的金屬絲或更高的金屬絲密度可能導致更高的金屬覆蓋率或更低的孔隙度。孔密度定義為每個面積內FD壁內的開放單元或孔的數量,并且更具體。這些特征將決定器械如何將血流從動脈瘤中導流出去并讓其在里面停滯。增加編織內的金屬絲數量、PPI和層數將減少孔隙度,并增加孔密度和金屬覆蓋率。另一個考慮因素是載瘤血管的曲率。對于給定的器械,在彎曲段中釋放時,器械靠近曲線外緣的區域的孔隙度將更大。市場批準的FD的孔隙度和孔密度通常在50%–70%和13–30 pores/mm2范圍內。
材料選擇
由于各種通常相互關聯的結構性質,選擇用于構建編織絲的材料對FD的整體性能有顯著影響。舉例說明,考慮一種在FD設計中關鍵的材料特性:彈性模量(也稱為楊氏模量),它衡量材料單位應變下對彈性變形的抵抗程度,或者簡單地被視為彈性剛度。彈性模量與整體器械剛度和性能的關系并不直接,因為存在其他影響因素。例如,結構剛度更多地取決于導絲直徑和編織參數,而不僅僅是彈性模量。此外,其他現象,如局部屈服和彈性應變極限,可以根據邊界條件大幅改變實際器械的響應。
具有較高彈性模量的材料在變形時需要更多的能量,但當它們恢復到原始形狀時會釋放更多的能量(可以想象成一根硬彈簧和一根軟彈簧之間的區別)。相反,具有較高彈性模量的材料通常顯示較低的彈性應變極限,這可能會降低尺寸恢復能力,或者說是器械在被壓入導管后能夠重新膨脹的直徑。因此,具有較高彈性模量的編織絲組成的FD可能會表現出更高的張開力或在貼壁之前由于尺寸恢復不足而失去力,并且可能需要更大內徑的微導管來進行補償。鈷-鎳-鉻合金已經被優化來增加彈性模量,因此通常被選擇作為FD材料。PipelineEmbolization Device(PED;Medtronic)和Surpass Evolve(Stryker)主要由鈷合金絲組成。
另一個關鍵的材料特性是彈性應變極限,它定義為材料在經歷永久形狀改變之前可以被變形的程度。在FD應用中,較高的彈性應變極限允許器械被壓縮到更小的直徑,并可以圍繞更彎曲的曲線進行彎曲,同時仍保持自我擴張到原始釋放形狀的能力。這一特性對于導航到更遠端動脈瘤尤其有利,因為那里的載瘤動脈直徑更小,迂曲度更大。鎳鈦合金已經被優化以通過相變和相關的超彈性來增加彈性應變極限,因此也是常用的FD導絲材料。FRED和p64(phenox)主要由鎳鈦絲組成。
鈷-鎳-鉻和鎳鈦代表了基于它們的機械性能而選擇的優秀材料,但它們的不透射線度較低。相對高不透射線密度的材料,如鉭、鉑或鉑-鎢合金,被用于提供比鈷-鎳-鉻或鎳鈦等材料更好的顯影性,以幫助在透視引導下進行輸送。所有市場批準的FD都在其結構中加入了某種不透射線元素。例如,PED和Surpass Evolve在它們的編織中采用了鉑-鎢絲,而FRED則在器械的兩端附有鉭標記,并在層之間采用統一的鉭絲。傳遞不透射線性的另一種方法是使用DFT絲。DFT絲包含一個內芯絲,通常由不透射線的鉑或鉭組成,外層包裹著鎳鈦或鈷-鎳-鉻合金。由DFT絲構建的FD旨在在整個器械長度范圍內提供均勻的不透射線性,同時利用鎳鈦或鈷-鎳-鉻合金的優勢機械性能。Silk Vista Baby(Balt)和DERIVO FD(Acandis)是采用鎳鈦外層/鉑內芯DFT絲構建的CE批準FD的示例。Pipeline Vantage則采用了鈷合金外層/鉑內芯DFT絲。表1和表2總結了材料特性以及由傳統FD材料構建的市場批準FD的示例。

表1. 市場批準FD中使用的基材的性能。a:在應用建模值時要適當考慮楊氏模量和彈性極限(對于鎳鈦來說是偽彈性)可能會因工藝結構、紋理和強度結果而有很大差異。這里給出的是現實的可能結果,取決于供應商的生產路徑和目標結果。

表2. 市場批準的FD中使用的不透射線材料的特性。通過一致的方法,密度是作為不透射線度的粗略代理,以代替缺乏這些材料和幾何形狀的確證數據。未來的研究,超出了目前的范圍,可能會側重于作為材料、幾何形狀、過濾材料和成像參數的函數進行定量輻射透視性比較。這樣的研究可以用來輔助未來器械的設計。
表面修飾
對FD的表面進行改性是改善器械性能的另一種方法。導絲的表面可以通過電、化學或機械方式進行改變或涂層,以產生有益效果。表面改性旨在減少血栓形成、增加內皮化和/或作為潤滑劑以減少輸送力。一些市場批準的FD具有特定的表面改性,旨在提高臨床療效,而FD表面改性仍然是研究的熱點話題。PED的新版本采用了Shield Technology(Medtronic),這是一種沉積在編織絲表面上的磷脂膽堿層,旨在減少血栓形成和增加內皮化。體外研究表明相對于未涂層的PED,其血栓形成能力降低。體內研究表明由于涂層,血栓形成能力降低,內皮化速度更快。DERIVO FD編織絲經過處理形成表面氧化物和氧氮化物,稱為BlueXide,旨在減少摩擦/輸送力和血栓形成能力。FRED的新版本FRED X采用了聚(2-甲氧基乙基丙烯酸酯)涂層,已被證實在體外可減少血栓形成能力。p48的新版本p48_HPC(phenox)采用了抗血栓形成的糖基親水涂層,在接受單一抗血小板治療的5例未破裂動脈瘤患者中顯示出了有前景的結果。
未來方向
隨著FD的臨床應用日益普及,對FD技術進行研究和開發的強度也日益增加。日益增長的臨床FD性能數據可用于設計下一代器械。計算血流動力學方法正在被應用于更好地理解囊狀血液淤積和動脈瘤閉塞的最佳FD設計參數。活性表面涂層正在被設計出來以賦予治療效果。例如,釋放一氧化氮的涂層在減少血栓形成和增加血管支架內皮化方面表現出潛力。肝素或其他含抗凝劑的涂層也可能減少血栓形成。蛋白質可以附著到器械表面,以促進內皮細胞的捕獲和增殖。可生物降解的FD也在研發之中。這些器件旨在在治愈動脈瘤后溶解,減輕或消除與常規FD永久存在相關的并發癥。
總結
大多數介入醫生對血流導向裝置(FD)的性能理解是基于他們的臨床經驗。FD的選擇可能與個人偏好以及特定醫療中心可獲得的FD有關。此外,某些器械僅在特定地理區域獲得了市場批準。例如,PED、Surpass和FRED是目前在美國可用的三種FD;Silk、p64和DERIVO來自獲得CE批準的歐洲公司,而Tubridge(MicroPort)在中國獲得了國家藥品監督管理局的批準。地理可用性影響了特定地區某些器械的受歡迎程度。每種FD都具有獨特的設計,因此具有自己一套優點和缺點。對工程設計原則和臨床性能之間關系的更全面理解可能有助于介入醫生在不斷增長的FD市場中不斷前行。此外,我們相信這種提高的理解可以促進臨床醫生和工程師之間的合作,最終加速FD技術的發展。

來源:TRA of Neuro


