一、 背景
藥物開展臨床試驗需要經(jīng)過IND和倫理審查的雙重同意方可開展進(jìn)行,IND由藥監(jiān)機構(gòu)負(fù)責(zé)審批(國內(nèi)已實行默示許可制度),倫理審查一般由研究機構(gòu)設(shè)立的倫理委員會把關(guān)。關(guān)于倫理審查有關(guān)的法規(guī),從2007年的《涉及人的生物醫(yī)學(xué)研究倫理審查辦法(試行)》至今已有9部相關(guān)法規(guī)意見等發(fā)布。
本文將關(guān)注涉及人的藥物臨床試驗的倫理審查的內(nèi)容。臨床試驗的倫理審查包括三個階段:臨床試驗啟動前、臨床試驗進(jìn)行中和臨床試驗結(jié)束。
本文中的倫理審查指臨床試驗啟動前的審查,該階段的倫理審查目的是通過倫理,開展臨床試驗。
二、 倫理審查關(guān)注內(nèi)容
倫理審查的主要目的保證受試者尊嚴(yán)、安全和權(quán)益,重點關(guān)注臨床方案設(shè)計的科學(xué)性、倫理和理性等, 對于臨床研究項目,倫理審查主要包括以下內(nèi)容,現(xiàn)羅列主要內(nèi)容,其他詳見法規(guī)。
(1)研究者的資格、經(jīng)驗是否符合臨床研究的要求;
(2)研究方案是否符合科學(xué)性和倫理原則的要求;
(3)受試者可能遭受的風(fēng)險程度與研究預(yù)期的受益相比是否合理;
(4)在獲取知情同意過程中,向受試者或其法定監(jiān)護(hù)人提供的有關(guān)
信息資料是否完整通俗易懂,獲得知情同意的方法是否適當(dāng);
(5)對受試者的信息和資料是否采取了保密措施;
(6)受試者入選和排除的指南是否合適和公平;
(7)是否向受試者明確告知他們應(yīng)該享有的權(quán)利,包括在研究過程中他們可以隨時退出研究而無須理由,且不因此而受到不公平對待的權(quán)利;
(8)受試者是否因參加研究而獲得合理補償,如因參加研究而受到損害甚至死亡時,給予的治療以及賠償措施是否合適;
(9)研究人員中是否有專人負(fù)責(zé)處理與知情同意獲得過程和受試者安全相關(guān)的問題;
(10)對受試者在研究中可能承受的風(fēng)險是否采取最小化的措施;
(11)研究人員與受試者之間是否存在可能會影響研究人員專業(yè)判斷的利益沖突
三、 倫理審查流程
關(guān)于倫理審查流程,分為初始審查和復(fù)審兩大步驟,初審不通過時,對不合格的地方進(jìn)行修正之后再進(jìn)行復(fù)審申請。總體上包括申請遞交-受理-形式審查-會議審查/快速審查-審查意見-簽發(fā)批件/不同意等步驟,但是倫理審查具體的權(quán)限由醫(yī)療機構(gòu)的倫理委員會實施把握,所以落實到每個倫理委員會會有不同,申請遞交的資料清單模板等以醫(yī)療機構(gòu)發(fā)布的為準(zhǔn)。
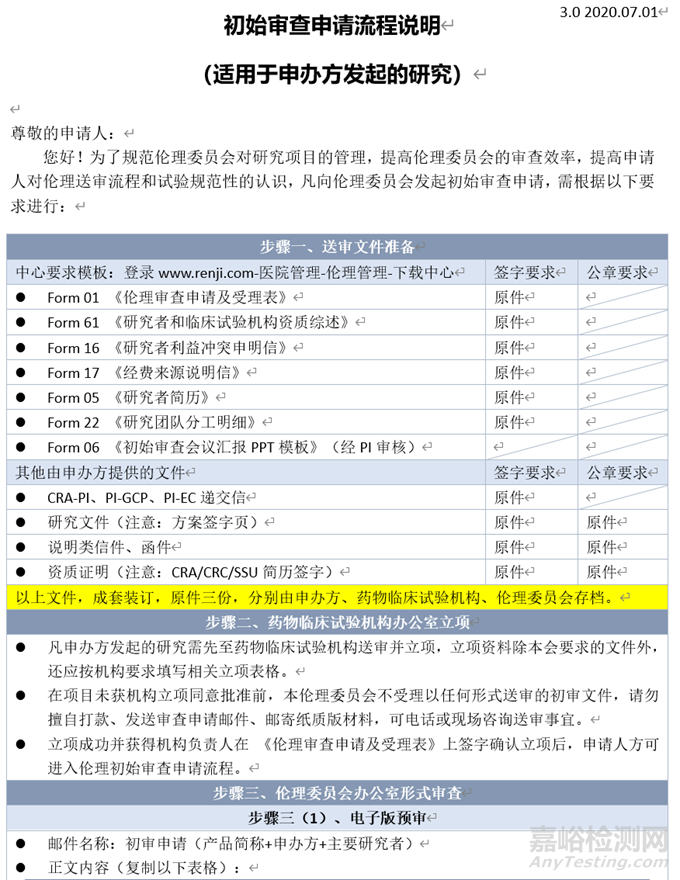
本文以仁濟(jì)醫(yī)院為例,倫理審查初審的流程如下:
步驟一:送審文件準(zhǔn)備;步驟二:藥物臨床試驗機構(gòu)辦公室立項;步驟三:倫理委員會辦公室形式審查:步驟三(1)電子版預(yù)審,步驟三(2)紙質(zhì)版受理;步驟四:初審費用支付;步驟五:接受倫理審查;步驟六:審查決定獲取等。
四、 遞交文件準(zhǔn)備
遞交文件準(zhǔn)備包括遞交文件的清單和遞交文件的模板填寫,如上文所訴,具體文件準(zhǔn)備以倫理委員會的要求為準(zhǔn),以仁濟(jì)醫(yī)院為例。首先登陸仁濟(jì)醫(yī)院官網(wǎng),點擊醫(yī)院管理下的倫理管理,進(jìn)入倫理管理頁面。
倫理管理包括院內(nèi)科研和注冊臨床兩種。
點擊規(guī)范流程
可以發(fā)現(xiàn),注冊臨床有初始審查流程、復(fù)審申請流程、安全性報告送審流程。點擊初審審查流程(復(fù)審?fù)恚瑸樯暾埲颂峁┑脑敿?xì)說明初始審查申請的word文件。
該文件對于流程步驟以及需要提交的文件都有詳細(xì)說明。
對于遞交的文件,倫理委員會對有的文件會提供模板,該部分文件必須按照模板進(jìn)行填寫準(zhǔn)備,可以在下載中心中下載。
對于下載中心未提供的文件模板,可以由申辦者自行準(zhǔn)備。
五、 總結(jié)
關(guān)于倫理初審審查的流程以及文件遞交的要求,不同的倫理委員會可能會有差異,本文僅以仁濟(jì)醫(yī)院的倫理委員會為例進(jìn)行演練,具體到不同的項目,方法基本相同。