您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2025-09-29 09:30
1、如何完善中間產品存放時限驗證?
如何完善中間產品存放時限驗證?需要根據車間實際生產工序(生產設備、生產工藝、中間產品存放條件)指導小試開發,再根據小試開發結果指導中試放大生產過程中的中間產品存放時限確認,再根據中試放大生產的中間產品存放時限確認的結果指導工藝驗證過程中的中間產品存放時限的驗證,從而形成科學、合理的中間產品存放時限。
中間產品存放時限的開發:
①:評估生產工序對中間產品存放時限的風險;
②:分析可能影響中間產品存放時限的工藝參數,進行小試開發;
③:根據小試開發結果進行中試放大生產確認;
④:根據中試放大生產確認的結果指導工藝驗證;
⑤:商業化后持續監測產品工藝,形成科學合理的中間產品存放時限;
2、中間產品存放時限的風險評估
(1)關鍵工藝步驟風險評估
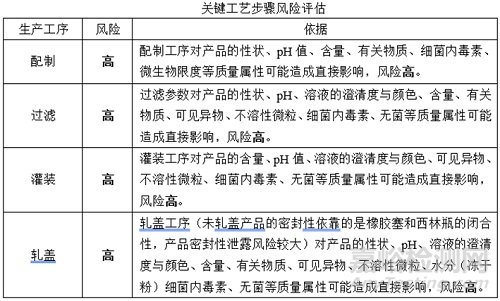
(2)關鍵工藝參數風險評估
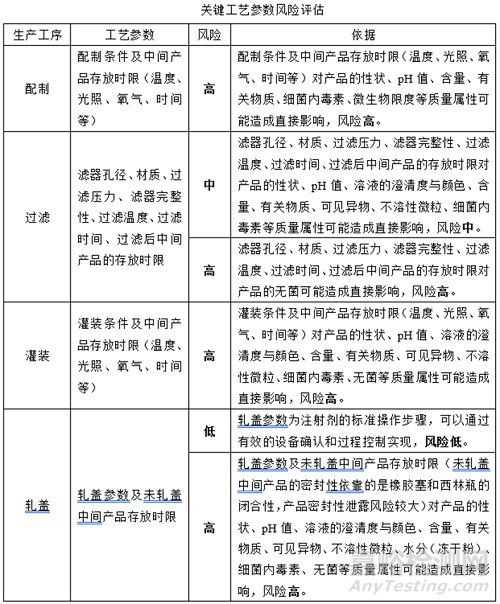
(3)生產過程中的中間產品存放時限
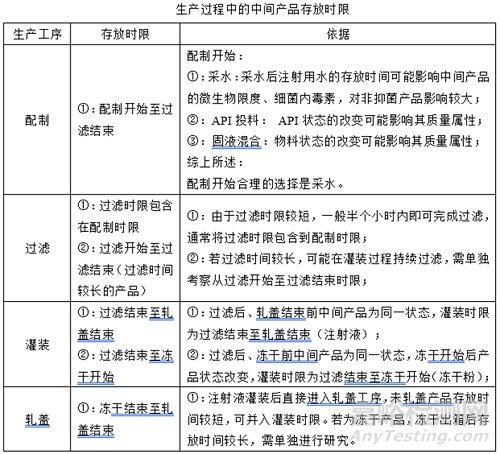
(4)確定生產過程中的中間產品存放時限
①:配制時限:配制開始至過濾結束;
②:過濾時限:過濾開始至過濾結束(適用于過濾時間較長的產品);
③:灌裝時限:過濾結束至軋蓋結束(注射液);
④:灌裝時限:過濾結束至凍干開始(凍干粉);
⑤:凍干結束至軋蓋結束(凍干粉);
3、小試開發過程中的中間產品存放時限研究
(1)配制、過濾及灌裝過程中的中間產品存放時限

注:配制、過濾及灌裝過程中的溫度、時限需根據產品實際生產所需適當調整。
4、中試放大生產過程中的中間產品存放時限
根據小試開發結果設計中試放大生產中的中間產品存放時限。
(1)配制時限

注:
①:配制開始以采水開始計算;
②:0h取配制結束的樣品;
③:配制開始后10h開始過濾或過濾后留一部分藥液用于中間產品存放時限取樣;
④:考察時間點、考察項目隨產品特性、生產實際情況靈活調整;
(2)灌裝時限


注:
①:注射液需連續或間隙式灌裝14h,穩定性樣品取灌裝后期樣品;
②:凍干粉需連續或間隙式灌裝14h,穩定性樣品取灌裝后期樣品,過濾結束14h后開始凍干;
③:考察時間點、考察項目隨產品特性、生產實際情況靈活調整;
(3)軋蓋時限

注:
①:注射液灌裝后隨即進入軋蓋工序進行軋蓋,可將軋蓋時限并入灌裝時限;
②:凍干粉凍干結束后開始軋蓋,未軋蓋樣品在凍干機或A級層流下可能停留數個小時等待軋蓋,需單獨研究軋蓋時限;
③:考察時間點、考察項目隨產品特性、生產實際情況靈活調整;
5、工藝驗證過程中的中間產品存放時限
可根據中試放大生產過程中的中間產品存放時限的結果調整并設計工藝驗證過程中的中間產品存放時限,以保證生產工藝穩定、可控,可穩定、持續的生產出符合質量要求的產品。
6、參考資料
1.化學藥品注射劑滅菌和無菌工藝研究及驗證指導原則(試行).
2.國家藥品監督管理局.關于發布除菌過濾技術及應用指南等3個指南的通告(2018年第85號).
3.EU.GMP Annex 1 : Manufacture of Sterile Products(2020).
4.EMA. Guideline on the sterilisation of the medicinal product, active substance, excipient and primary container(2019).
5.PDA Process Simulation Testing for Aseptically Filled Products Technical Report No. 22 (2011 Revision) of PDA.

來源:藥事縱橫


