您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2022-04-02 16:01
前言
當前,隨著國內生物醫藥的快速發展,越來越多的生物制藥企業的產品研發進入產業化階段。在生物制藥領域里,質量源于設計(QbD)是一種系統化、結構化、基于科學和風險的藥品研發方法,是一種對產品、工藝和分析方法進行科學有效管理的重要工具。目前單抗領域是生物制藥行業發展最快,也是相對成熟的領域之一,關于QbD的在單抗制品的開發中應用的報道越來越多,本文簡述了單抗制品細胞培養生產工藝中應用QbD的概念和初步想法。
細胞培養生產工藝
抗體藥物的原液生產大體可分為上游工藝(又稱細胞培養)、下游工藝(又稱純化)2個環節,每個環節都擁有其核心技術,這些核心技術環環相扣,形成了抗體藥物生產企業的核心競爭力。一個典型的單抗藥物的商業化生產流程-上游工藝(細胞培養)一般采用以下步驟:細胞復蘇與傳代→擴增培養→細胞大規模培養→細胞分離(可屬于下游工藝)。
01細胞復蘇與傳代
將種子放置在恒溫的水浴鍋中,一般溫度控制在如35℃左右,預熱如30min,將工作細胞庫細胞進行解凍復蘇,根據工藝要求控制解凍時間,然后將解凍細胞加入至培養基中,離心分離后轉入搖瓶中(如250 mL),進行搖瓶傳代。注意控制CO2濃度、培養溫度、培養時間等因素,同時也要根據工藝的要求控制接種的密度,控制細胞活率等要求。將上述的復蘇種子細胞按照一定的密度稀釋至新搖瓶中(如500 mL/2000mL),控制溫度、CO2濃度、溶氧濃度、培養溫度、培養時間、搖床搖擺速度、pH等因素,逐漸擴增細胞數量至滿足一級種子罐的接種要求。
02擴增培養(亦稱種子培養)
一級種子培養
將搖瓶種子細胞按照一定的密度接種到一級種子罐內(如20 L),控制溫度、CO2濃度、溶氧濃度、培養溫度、培養時間、攪拌速度、pH、培養基等因素,逐漸擴增至細胞數量滿足二級種子罐的要求。
二級種子培養
將一級種子按照一定的密度接種到二級種子罐內(如50 L),控制溫度、CO2濃度、溶氧濃度、培養溫度、培養時間、攪拌速度、pH、培養基等因素,逐漸擴增至細胞數量滿足三級種子罐的接種要求。
三級種子培養
將二級種子按照一定的密度接種到三級種子罐內(如100 L),控制溫度、CO2濃度、溶氧濃度、培養溫度、培養時間、攪拌速度、pH、培養基等因素,逐漸擴增至細胞數量滿足細胞發酵培養的接種要求。
03細胞大規模培養(亦稱生物反應器細胞培養)
種子擴增后要進入細胞大規模培養階段,注意控制溫度、CO2濃度、溶氧濃度、培養溫度、培養時間、攪拌速度、pH、培養基等因素。細胞培養結束后,可采用離心分離或澄清過濾等方法進行抗體蛋白的分離純化。
基于QbD理念的細胞培養工藝開發
質量源于設計(QbD) 核心理念在于“質量是通過科學合理的設計得以實現的,而不是僅僅依靠最終檢驗出來的”。自2013年起,美國 FDA 對于新的藥品批準申請,監管部門均要求采用QbD方法。近年來,QbD的理念已逐漸成為國內企業大多數藥品生產和研發企業共識,在單抗制品的細胞培養工藝開發中應用的報道越來越多,基于QbD理念的藥品開發基本流程,ICH Q8中提到的質量源于設計QbD的方法如下圖所示:
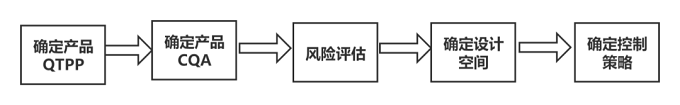
基于QbD理念的細胞培養工藝開發:首先要界定目標產品的質量概況(QTPP),即以預先設定的目標產品質量概括(QTPP)為研發的起點,在了解關鍵物質屬性(CMA)的基礎上,通過試驗設計(DOE),理解產品的關鍵質量屬性(CQA),確立關鍵工藝參數(CPP),在原料特性、工藝條件、環境等多個影響因素下,建立能滿足產品性能的且工藝穩健的設計空間(DS),并根據設計空間,建立質量風險管理,確立質量控制策略和藥品質量體系,整個過程強調對產品和生產的認識。QbD可以幫助我們更好地理解產品和工藝,增強單抗制品的穩定性,降低GMP生產的復雜性和成本等。
那么細胞培養過程中設計空間如何確定一直是大家都感興趣的話題,自從2021年6月25日,CDE發布實施《已上市生物制品藥學變更研究技術指導原則(試行)》,正式在官方指導原則提到設計空間的概念,一石激起千層浪,下面我就來分享一下細胞培養過程中設計空間確定的流程,因為個人認知的局限性,如有不足,歡迎留言補充。細胞培養操作空間一般由申辦者在注冊時提出,監管機構(如CDE)評估和批準,在設計空間的確定過程中,需要量化不同參數對工藝過程產品表現的影響:如產量和質量,按影響程度通常分為非重要工藝參數(Non-KPP),重要工藝參數(KPP)、關鍵工藝參數(CPP),細胞培養過程中設計空間(DS)確定流程一般如下(可供參考),
01評估細胞培養過程中所有工藝過程參數
首先以適當的評估工具(如FMEA)評估細胞培養過程中所有工藝過程參數,確定細胞培養工藝表征中需要研究的參數,因不同生物制品自身特點不同,細胞培養過程中工藝過程參數也會有所差別,評估后的工藝表征中需要研究的參數也會有所差別。因此相關研究人員須具備足夠的培養工藝知識積累、風險評估和風險管控的能力。在實施評估時,基于風險,前瞻性設計研究方案,開展充分的研究,不同階段細胞培養,評估的參數對象也會有所差別,一般情況下分細胞復蘇與傳代、各級種子培養、細胞大規模培養分別進行評估細胞培養過程相關工藝過程參數,如某藥企大規模生產階段細胞培養過程相關工藝過程參數如下表:

02建立工藝縮小模型
其次建立工藝縮小模型;在縮小模型基礎上,進行試驗設計(DOE)參數篩選實驗,去除非重要工藝參數(Non-KPP),確定重要工藝參數(KPP),對影響產品質量的參數進行響應曲面設計(RSM)實驗設計,建模,確定關鍵工藝參數(CPP)操作空間,如在風險評估階段確定了生產培養步驟中的4個潛在的關鍵工藝參數(CPP)(IVCD、Culture duration、pH和Temperature),最后進行最差條件實驗進行操作空間確認,確認的范圍如下表:


來源:允咨GMP制藥技術


