您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2022-03-26 02:39
[摘要] 本文對美國非處方藥進行研究,發現非處方藥具有安全窗寬、無需執業醫師指導用藥等特點,這些特點決定了非處方藥在上市路徑、申報資料遞交、審評及監管、標簽等方面與處方藥存在差異。此外,還對美國2020年3月27日實施的非處方藥改革進行研究,以期為我國非處方藥的申報、審評和監管提供參考。
處方藥( Rx) 與非處方藥( OTC) 是基于藥品自身的安全性、用藥過程安全性( 是否需要監測以及用藥的復雜性等) 對藥品進行分類的一種方法。Rx由執業醫師處方用藥,OTC不需要憑處方便于消費者購買和使用,對藥品實施分類監管,可以合理分配監管資源,也可以大大降低處方成本、就醫費用等。
Rx與OTC除了在自身安全性和使用安全性、方便性方面存在區別外,在上市途徑、申報資料遞交、說明書、包裝( 自我藥療會以更小的包裝供應)及上市后監管等方面也有所不同。OTC與處方藥品的分類不僅與成分有關,還與適應證和藥物劑量有關,例如同一活性成分( API) 的不同劑量和/或適應證可能屬于不同分類,即所謂“雙跨品種”,如高劑量的布洛芬用于治療關節炎為Rx,低劑量用于治療頭痛及其他疼痛屬OTC。
本文就美國OTC的定義和特點、上市路徑、申報資料遞交、專論程序的改革、OTC審評及監管部門、標簽等方面進行研究,以期為我國OTC的申報、審評和監管提供指導。
1、定義和特點
根據美國《聯邦食品藥品化妝品法》,按照Rx監管的人用藥品是指只有在執業醫師的指導下使用才能保證安全的藥品,包括毒性較大或具有其他潛在有害反應、使用方法復雜或使用時需要監測的藥品[1]。
OTC藥品應當具有以下特點: 安全、有效且安全性范圍寬,作為OTC藥品獲益大于風險; 誤用和濫用可能性較低; 患者對需治療的疾病可以自行診斷; 不需要執業醫師進行安全、使用方面的指導; 標簽內容足以使消費者能夠自我診斷、自己選擇、自行服用、決定何時停藥[2]。
在進行OTC的風險和獲益評價時,FDA通常會考慮消費者是否可以理解并遵守標簽、說明書的內容進行服藥,患者是否可以自行診斷疾病,或至少了解其擬治療的癥狀,以及在持續使用藥品的過程中是否需要進行體檢或實驗室檢查[3]。
2、上市路徑
OTC主要可劃分為2條上市路徑,即注冊路徑( NDA、ANDA或補充申請) 和專論路徑( 修訂專論或按專論申請上市) ,見圖1。
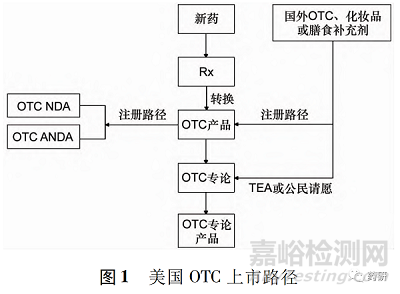
2.1 注冊路徑
2.1.1 新藥申請或者仿制藥申請路徑 新化學成分、新的復方組成或已有化學成分的新適應證、新劑型或新給藥途徑,通常情況下按新藥申請(NDA)。
企業須按照新藥申請的格式遞交相關數據,以證明產品作為OTC預期用途的安全性、有效性。按照新藥路徑批準的OTC,其數據保護期一般按NDA藥品的保護期執行。也可以以仿制藥形式,按照仿制藥申請( ANDA) 路徑上市。
2.1.2 已有產品的 Rx-OTC 轉換( 補充申請或新申請) Rx-OTC轉換是指先前按照Rx上市的產品以相同的適應證、規格、劑量、使用方法、使用療程、劑 型、使用人群和給藥途徑按照非處方上市( 完全轉換) ; 或按照Rx上市的藥品,其活性成分仍然屬于Rx成分,但上述其余內容被擬定為OTC產品( 部分轉換) [4]。
無菌制劑關鍵技術解析與發補情況、現場核查
FDA PAI檢查流程、應對措施與新時代下數據完整性
清潔驗證、工藝驗證、設備確認及驗證主計劃
M4格式申報資料撰寫與藥品注冊現場核查要點解析
考慮Rx 在轉換為OTC之前通常已經上市多年,Rx-OTC轉換受到內在特殊不良事件和外在自我選擇理解能力、使用說明、自我給藥等因素的影響。Rx-OTC轉換無劑型限制,凡是批準的劑型都可以轉換[2]。提出轉換申請的主體可以是批準Rx的上市許可持有人或其他主體。
大多數Rx-OTC轉換都屬于部分轉換,即活性成分仍然屬于Rx,而特定的適應證、規格或劑型通過NDA申請獲批OTC,例如,局部抗真菌劑治療足癬、癬菌病和股癬時,屬于OTC藥品,而治療花斑病時,屬于Rx[5]; 另一種情況是Rx-OTC完全轉換,通過新藥補充申請( sNDA) 轉換,活性成分不再屬于Rx成分。例如Miralax? ( 聚乙二醇) 、Rhinocort? 抗過敏噴劑( 布地奈德) 等[6]。
截至2016年5月4日,美國約有40種Rx的活性成分通過轉換成為OTC的活性成分[3]。1980年之前都是通過專論審核途徑轉換為OTC,大部分是批準活性成分轉換,而不對單個產品進行轉換。轉換過程中FDA考慮的關鍵問題是患者自己使用藥品時,是否可以達到預期的療效而不產生安全性問題。轉換的重點研究工作是證實標簽的可讀性、能否自我選擇( self-selection and deselection) 、依從性等。這就要求轉換后的OTC說明書內容須做到通俗易懂,突出重點信息[7]。如果擬定增加新適應證或新患者人群時,還需要進行消費者研究以評價產品成為OTC的可能性,原Rx 標簽中需要解決的問題以及產品的臨床使用。OTC轉換過程中需補充臨床試驗數據的,一般給予3年的市場獨占期作為激勵[8]。
2.2 專論路徑
自1972年建立專論以來,目前,美國列出的OTC專論涵蓋90多個治療類別,800多種活性成分,1400多種適應證[9 - 10]。
OTC專論明確了上市OTC活性成分的安全性、有效性及標簽內容要求。OTC專論持續更新,根據需要增加新的活性成分和標簽內容。專論的修訂可以采取時間和范圍覆蓋申請( time and extent appli- cation,TEA) 程序和公民請愿程序。
2.2.1 TEA 程序 所謂TEA程序是指尚未在美國以藥品身份上市的產品納入OTC專論體系,需要提供在其他國家或地區作為OTC 藥品上市使用的歷史,至少在一個國家連續銷售5年以上,并有足夠的使用人群。FDA基于資料評價TEA申請是否可以直接納入OTC專論。目前已有多個藥品按照這種途徑獲得FDA批準[11]。
FDA法規對納入OTC專論的藥品建立了標準和程序。通過TEA程序納入OTC 專論可以是以特定“條件 ( condition) ”納入( “條件”包括: 活性成分或植物藥成分的描述、藥理類別、擬定OTC用途等) ,也可以要求創建新專論。在 TEA框架下,美國以外按照化妝品或膳食補充劑上市的產品可以以OTC 藥品在美國上市。如果OTC藥品的“條件”僅在美國以外的一個國家獲得批準或者在1972年開始的美國OTC藥品審評以后,那么該產品只能按照聯邦食品、藥品和化妝品法( FD&CA) 505條款通過注冊途徑獲得上市批準。
FDA通常在收到TEA申請的1年內做出是否有資格納入專論的決定。對于納入最終專論的“條件”,法規要求活性成分或植物藥成分需收載于美國藥典專論,并闡明其鑒定、規格、質量和純度等標準。
2.2.2 公民請愿程序 通過公民請愿的方式可以申請修訂或撤銷擬定或最終OTC專論中的“條件”。公民請愿程序不可以用于TEA相關申請。公民請愿程序公開、不收費。以往通過提交公民請愿程序修訂OTC藥品專論通常比新的NDA申請用時更長。
2.3 專論修訂程序的改革
2020年3月前,OTC專論的增加、刪除或修訂需要經過擬議規則制定的提前通知、暫定最終專論和最終專論等3個法定程序[12]。這種采用法規程序增減OTC專論的方式,在解決重大安全性問題時,無法及時對 OTC 專論進行修訂。2020年3月27日美國通過了《新冠病毒援助紓困經濟安全法》 ( Coronavirus Aid,Relief,and Economic Security Act,簡稱CARES 法案) ,該法案中倡導對美國OTC專論藥品的監管進行改革和現代化,旨在通過行政命令程序代替法規程序對專論增加、刪減或修訂內容,行政命令程序有助于在OTC藥品審評過程中提高效率、提升時效性和增強可預測性,從而促進創新,建立快速解決安全性問題的機制,盡早完成待定專論的審評[13 - 14]。企業和FDA均可發起行政命令程序,企業遞交OTC專論命令申請( OTC monography order request,OMOR) ,FDA負責受理、審評、擬定命令、發布最終OTC專論。當藥品出現緊迫的安全性問題或更改藥品標簽、藥品分類等緩解與藥品使用相關的重大或嚴重風險時,FDA可以使用加速程序發起命令。
隨著OTC專論的改革,某些按照OMOR申請對OTC專論最終命令進行變更的申請人可能獲得18個月的市場獨占期。包括藥品中含有的活性成分( 活性成分的酯基或鹽基) 尚未包含在非NDA申請的某些非處方藥品中; 或對藥品使用條件進行變更,而申請人為變更使用條件所開展或申辦的新的人用數據研究對命令的頒布起了關鍵作用。OTC專論的其他變更不會授予市場獨占權,例如安全相關變更,或其他FDA認為是為確保安全使用所做的必要變更、安全性或有效性檢驗方法的相關變更等。
2.4 按專論申請
OTC專論按治療種類分類,每個治療種類包括多種活性成分; 同一活性成分也可能被列入多種不同類別的OTC專論中[10]。如果OTC符合專論,企業在制定成分表/標簽時可參考專論,無需 FDA 批準即可上市銷售,若不符合專論,則需進行審評[15]。
由OTC活性成分組成的復方制劑,除了可用于單個成分治療適應證的安全性和有效性之外,OTC審評程序還為某些被認為是安全有效( GRASE) 的成分的固定組合產品上市提供了依據。
3、注冊路徑與按專論申請路徑的比較
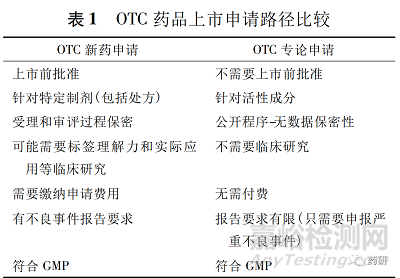
申請人可以按照505FD&CA注冊路徑進行新OTC藥品“條件”的申請或申請變更最終專論的OTC藥品“條件”( 21CFR330.11) 。按照注冊路徑( 505) 獲得特定產品的批準與公民請愿程序TEA程序相比,有一定的優勢。例如,批準過程保密,某些產品可能獲得一定的市場獨占期,批準所需時間更短。但注冊路徑( 505) 批準也有其劣勢: 僅針對特定藥品( 包括劑型和標簽) 的批準; 除了不良事件報告外,還有其他報告要求; 某些藥品后續變更標簽和劑型需要提交變更申請,這些申請可能需要繳費。
新藥、仿制藥或補充申請和專論審評都是 FDA基于科學審查做出的決策,見表 1。
4、OTC 審評及監管部門
美國的OTC的審評和上市后監管均在CDER。伴隨著2020年3月27日OTC改革,FDA對OTC的組織機構也進行了改革[16]。原OTC的審評、監管是在 CDER新藥辦公室下設的OTC處( Division of Non- prescription Drug Products,DNDP) ,改革后則由新成立的OTC辦公室( Office of Non-Prescription Drug, ONPD) 負責OTC的開發、審評及監管[17]。OTC 辦公室又分為OTC Ⅰ處和Ⅱ處( DNDP Ⅰ和Ⅱ) ,每個處負責不同OTC適應證。
OTC處負責OTC的INDs,NDAs,sNDA 的注冊審評及上市后監管包括Rx-OTC轉換。OTC審評時,OTC處是領導部門,負責組織、協調其他辦公室提出的有關科學建議的審評( 合作或咨詢) 、召開審評會議等。新藥辦公室的多個部門會參與OTC審 評,例如有效性數據可能需要Rx 審評部門的醫學/統計學專業意見,致癌性或其他動物毒性數據可能需要藥理毒理專業提供意見等。除了OTC處,另一個參與OTC審評的重要部門是專題評審處( Specific Subject Matter Review Division,SSMRD) ,專題評審處屬于新藥辦公室下設的各審評處,負責按生理疾病分類的臨床資料審評( 例如心血管藥物) ,OTC處和專題評審處分工明確( 見表 2) 。在 NDA階段,OTC處負責審評消費者研究資料、上市后安全性數據、 OTC標簽以及所有法規監管問題,在該階段,專題評審處與OTC處一起對臨床試驗相關的有效性、安全性數據進行審評。必要時,也可以咨詢臨床藥理學、統計學及化學部門意見[18]。

非處方藥咨詢委員會 ( Nonprescription Drugs Advisory Committee,NDAC) 協助OTC辦公室評價OTC專 論 產 品,目前已有30萬種OTC藥 品 上市[19 - 20]。CDER 合規辦公室的OTC藥品組負責消費者用藥風險管理。
5、OTC 標簽
由于OTC無需醫生處方,無需醫師或藥師指導和監督用藥,故其說明書是消費者了解藥品的主要途徑,消費者對藥品的認知直接影響了用藥的正確性。
OTC標簽必須包括預期用途、說明和警告,以便閱讀理解能力低下者都能理解。先前有研究發現美國OTC標簽的可讀性較差,難以找到產品說明、警告、批準使用及過敏信息。在美國,30% 的OTC由老年人購買,他們認為適應證、慎用、禁用等詞不容易理解[21 - 22]。
為提高OTC標簽可讀性,FDA于1999年制定了OTC 標簽可讀性法規,規定使用消費者友好型語言及進行格式標準化,使標簽的語言更容易理解,消費者知曉重要的信息所在位置。2010年,FDA出臺了《非處方藥標簽理解力研究指南》,FDA認為隨著人們教育程度和自我保健意識的不斷增強,有效地傳遞用藥信息將成為當務之急。
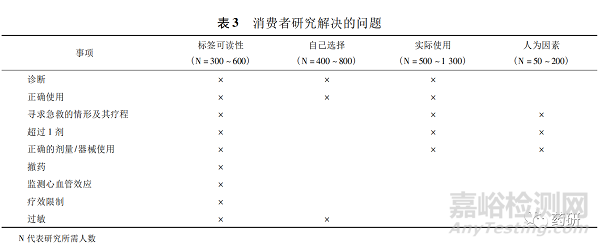
為了了解消費者對說明書內容的理解程度, OTC需要進行特殊的消費者研究[23]。消費者研究類型有標簽可讀性研究[24]( 對標簽關鍵信息的理解力) 、自己選擇研究( 選擇正確的產品) 、實際使用研究( 按照標簽上的說明使用) 、人為因素研究( 藥物相互作用) ,見表 3[2]。
截至2021年6月28日,FDA標簽數據庫收載人用OTC藥品標簽有90707 個,人用Rx 和生物制品標簽50485 個[25]。
6、討論與建議
6.1 根據OTC的特點,建立簡化的OTC審評路徑,區別于Rx審評路徑
美國OTC上市路徑主要包括專論、Rx 轉換、直接申報OTC以及成熟OTC改良等。從上市監管部門來說,美國OTC藥品上市前的審評及上市后監管都是由CDER負責,我國上市前審評、審批由藥品審評中心負責,Rx-OTC轉換由藥品評價中心負責; 從上市路徑看,我國未設立OTC專論路徑; 從注冊申報路徑看,我國OTC與Rx 從審評資料遞交、程序、路徑、上市后監管等方面無差別[27]。我國從2000年開始實施Rx和OTC分類管理,新修訂的《藥品注冊管理辦法》明確了Rx和OTC實行分類注冊和轉換管理[28]。分別由藥品審評中心和藥品評價中心制定OTC上市注冊相關和上市后轉換相關技術指導原則和程序。藥品審評中心于2020年7月6日發布了《化學藥品非處方藥上市注冊技術指導原則( 征求意見稿) 》[29]。
6.2 建立患者友好的 OTC 說明書規則
對于藥品說明書,我國有OTC范本,但說明書范本的內容與Rx 的說明書無差異,其表述方式晦澀難懂,存在可讀性差的問題,尤其是中藥,存在諸多尚不明確的內容,這不利于患者更好地理解說明書內容,可能造成用藥安全和有效性問題,應加強對OTC的上市后研究和監測,及時修改藥品說明書,更好地指導公眾合理用藥。目前,我國說明書理解力研究和監管要求仍屬空白[30],這也導致了我國OTC藥品說明書管理中存在諸多問題[31]。說明書內容能否很好地被消費者理解是保證消費者安全、有效使用OTC的關鍵,故建議我國參照美國開展消費者研究,并建立OTC標簽理解力研究和自己選擇研究等指導原則,指導申請人開展相關研究。
除了說明書外,提供更多途徑使消費者了解OTC藥品信息,加強培訓和廣告監督,提升自我藥療能力,避免在用藥決策上產生誤區,出現不合理用藥和濫用藥物等情況。雙跨品種從包裝設計上進行區分,避免消費者用藥混淆,將消費者用藥安全風險降到最低。
6.3Rx 轉換為OTC時,若需要額外的臨床研究,應適當給予市場獨占期鼓勵
對于潛在適用于作為OTC的藥品,鼓勵OTC的申報和及時轉換,對于按照創新藥申報的OTC或需要做臨床研究支持Rx轉換為OTC的情況,應當給予適當的市場獨占期激勵。利用現代技術允許更多的藥品以OTC身份上市,增加 OTC藥品數量,節省監管資源、醫師資源,更好地利用資源。

來源:Internet


