您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-06-27 23:34
脈搏波速度和踝臂指數檢測器械是以示波法通過袖帶傳感器取得的壓力和脈搏信號來自動完成間接測量的裝置。
一、脈搏波速度和踝臂指數檢測器械的結構與工作原理
1.脈搏波速度和踝臂指數檢測器械的結構
產品一般由主機、袖帶和附件組成。一般產品還帶有信號輸入輸出部分,主要用于測量數據的導出和管理。產品結構框圖舉例如圖1。
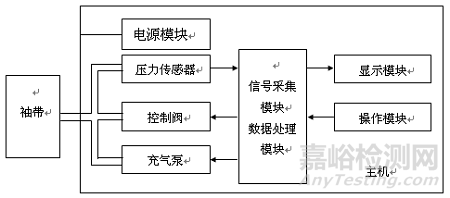
圖1. 產品結構框圖舉例
2.脈搏波速度和踝臂指數檢測器械的工作原理
測量腳踝和上臂的血壓比指數(簡稱“ABI”)以及脈(搏)波傳播速度(簡稱“PWV”)的原理如下:
1)腳踝和上臂的血壓比指數測量
采用示波法測量血壓,工作原理按測量方式為降壓測量法。降壓過程中,動脈內壓力振幅大小變化趨勢如圖2所示:

圖2. 動脈內壓力振幅大小變化趨勢
壓力傳感器采集大小變化的袖帶內壓力,將其轉化為數字信號送入CPU,通過軟件組件辨別動脈血流受阻過程中相應壓力點,根據經驗累積的軟件算法分別得出腳踝和上臂的舒張壓和收縮壓。并按照以下公式可以計算出ABI值:
ABI = 腳踝收縮壓/上臂收縮壓
2)脈搏波傳播速度測量
檢測某一個脈搏波到達腳踝和到達上臂、或是到達頸動脈—股動脈之間的時間差,可以在ABI的血壓測量過程中進行,也可以單獨進行。最終通過下面的公式計算出PWV:
baPWV = 腳踝至上臂的距離/時間差
cfPWV = 頸動脈至股動脈的距離/時間差。
二、脈搏波速度和踝臂指數檢測器械的研發實驗要求
1. 性能研究
應當包括產品性能研究以及產品技術要求的研究和編制說明,包括功能性、安全性指標以及與質量控制相關的其他指標的確定依據,所采用的標準或方法、采用的原因及理論基礎。
應描述所采用的國家標準、行業標準中不適用條款的理由。
2. 軟件研究
軟件研究應參見《醫療器械軟件注冊技術審查指導原則》(國家食品藥品監督管理總局通告2015年第50號)和《醫療器械網絡安全注冊技術審查指導原則》(國家食品藥品監督管理總局通告2017年第13號)。應給出一份單獨的醫療器械軟件描述文檔和一份網絡安全文檔,軟件描述文檔內容包括基本信息、實現過程和核心算法,詳盡程度取決于軟件的安全性級別和復雜程度。應在產品技術要求中明確軟件發布版本和軟件完整版本號的命名規則。
3.生物相容性研究
生物相容性評價根據GB/T 16886.1標準進行,應描述產品所用材料及其與人體接觸的性質,如:產品袖帶所采用的材料,與人體接觸為直接接觸。生物相容性評價研究應給出實施或豁免生物學試驗的理由和論證,并對現有數據或試驗結果進行評價。
4.消毒工藝研究
應明確所推薦的清潔、消毒工藝(方法和參數)及其確定依據,并給出驗證報告。
5.使用次數和包裝研究
1)使用次數的確定:應當給出產品壽命信息及驗證資料。
2)包裝及包裝完整性:應當給出產品包裝的信息,以及在宣稱的有效期內以及運輸條件下,保持包裝完整性的依據。
6.技術指標
應當按照《醫療器械產品技術要求編寫指導原則》(國家食品藥品監督管理總局通告2014年第9號)編制產品技術要求。
1)產品應符合YY 0670—2008中規定的要求。
2)產品應符合GB/T 14710—2009中氣候環境和機械環境II組的要求。
3)產品應符合GB 9706.1—2007中規定的要求。
4)產品應符合YY 0505—2012中規定的要求。
三、相關標準
表1. 產品適用的相關標準
|
標準編號 |
標準名稱 |
|
GB 9706.1—2007 |
醫用電氣設備第1部分:安全通用要求 |
|
GB 9706.15—2008 (如適用) |
醫用電氣設備第1—1部分:安全通用要求并列標準:醫用電氣系統安全要求 |
|
GB/T 14710—2009 |
醫用電氣環境要求及試驗方法 |
|
GB/T 16886.1—2011 |
醫療器械生物學評價第1部分:風險管理過程中的評價與試驗 |
|
GB/T 16886.5—2003 |
醫療器械生物學評價第5部分:體外細胞毒性試驗 |
|
GB/T 16886.10—2005 |
醫療器械生物學評價第10部分:刺激與遲發型超敏反應試驗 |
|
GB/T 16886.12—2005 |
醫療器械生物學評價第12部分:樣品制備與參照樣品 |
|
YY 0505—2012 |
醫用電氣設備第1—2部分:安全通用要求并列標準:電磁兼容—要求和試驗 |
|
YY 0670—2008 |
無創自動測量血壓計 |
|
YY/T 0316—2016 |
醫療器械風險管理對醫療器械的應用 |
|
YY/T 0466.1—2016 |
醫療器械用于醫療器械標簽、標記和提供信息的符號 |
|
YY/T 0664—2008 |
醫療器械軟件 軟件生存周期過程 |
|
YY/T 0708—2008 |
醫用電氣設備第1—4部分:安全通用要求:可編程醫用電氣系統 |
四、主要風險
產品的危害類型及形成因素舉例見表2。
表2. 產品的危害類型及形成因素
|
危害 |
可預見的事件序列 |
危害處境 |
損害 |
|
電磁 能量 |
在強電磁輻射源附近使用產品測量,干擾系統運行,測量錯誤、測量結果誤差過大。 |
依據過高讀數服用治療藥物,導致藥物劑量過量。 |
誤用藥物、嚴重時可能危及生命。 |
|
依據過低讀數不進行治療。 |
病情未即時控制,嚴重時惡化。 |
||
|
電源線中有雷擊能量 |
設備故障、壽命縮短。 |
設備無法及時使用。 |
|
|
靜電放電 |
干擾程序運行。 |
導致測量結果誤差過大、或數據擦除。 |
|
|
漏電流 |
產品配用漏電流超標的電源適配器 |
使用者、患者接觸時可觸及的帶電部分。 |
灼傷、嚴重時死亡。 |
|
熱能 |
使用負載能力較差的電源適配器 |
適配器中的部件過熱。 |
燙傷、嚴重時起火。 |
|
機械能 |
產品最高袖帶壓未作規定或限值過高、測量周期過長、放氣閥門故障導致放氣失敗。 |
過高、過長時間的壓力作用于人體。 |
淤血、感覺不適、外周血管阻滯。 |
|
產品意外墜落。 |
機械部件松動,液晶板接觸不良。 |
無法測量或測量誤差過大,數據無法讀取,嚴重時延誤治療。 |
|
|
不正確的測量 |
壓力傳感器長時間未經校準,壓力傳感器測量偏差、壓力傳感器超出使用壽命,傳感器測量偏差。 |
依據過高讀數進行治療或者服用藥物,導致藥物劑量過量。 |
誤用藥物,嚴重時可能危及生命。 |
|
依據過低讀數不進行治療。 |
動脈硬化未經控制,嚴重時引起病情惡化。 |
||
|
生物學 |
使用生物相容性不良的材質制作袖帶 |
人體接觸。 |
皮膚過敏、刺激。 |
|
化學 |
長時間不使用的電池未經取出,造成電池漏液。 |
電路腐蝕、設備故障,產品無法工作。 |
延誤治療。 |
|
操作 錯誤 |
使用不適當尺寸的袖帶,袖帶未扣緊。 |
未能對被測部位的血管完全壓迫。 |
測量失敗;測量值誤差過大,見“不正確的測量”。 |
|
測量部位與心臟高度不一致,被測者姿勢不良 |
測量部位與心臟壓力存在壓差。 |
||
|
測量時被測者活動,說話,情緒的變化。 |
壓力信號中混雜噪聲。 |
||
|
在產品規定的溫度范圍外測量。 |
超出傳感器溫度線性范圍。 |
||
|
不完整的說明書 |
未對錯誤操作進行說明。 |
見“操作錯誤”。 |
測量失敗;測量值誤差過大,見“不正確的測量”。 |
|
不正確的消毒方法。 |
使用有腐蝕性的清潔劑、消毒劑。產品部件腐蝕,產品無法工作。 |
延誤治療。 |
|
|
不正確的產品貯存條件。 |
器件老化,部件壽命降低。 |
產品壽命降低,導致測量值誤差過大,見“不正確的測量”。 |
|
|
未規定檢測方法。 |
傳感器存在偏差,未對設備進行校準。 |
見“不正確的測量”。 |

來源:嘉峪檢測網


