您當(dāng)前的位置:檢測資訊 > 科研開發(fā)
嘉峪檢測網(wǎng) 2025-02-12 09:01
摘 要: 建立了超高效液相色譜-串聯(lián)質(zhì)譜同時(shí)測定河蝦中地西泮和奧沙西泮殘留量的方法。樣品經(jīng)乙腈提取,全自動(dòng)MCX小柱凈化,采用Shim-pack GISS C18色譜柱(50 mm ×2.1 mm,1.9 μm)分離,以甲醇-0.1%(體積分?jǐn)?shù))甲酸溶液為流動(dòng)相進(jìn)行梯度洗脫,在電噴霧離子源正離子模式、多反應(yīng)監(jiān)測模式下進(jìn)行掃描檢測,內(nèi)標(biāo)法定量。地西泮和奧沙西泮的質(zhì)量分?jǐn)?shù)在0.1~10.0 μg/kg范圍內(nèi)與色譜峰面積線性關(guān)系良好,相關(guān)系數(shù)均不小于0.999 3,方法檢出限均為0.05 μg/kg。樣品的加標(biāo)平均回收率為83.1%~94.0%,測定結(jié)果的相對標(biāo)準(zhǔn)偏差為2.3%~7.8%(n=6)。該方法靈敏度高、準(zhǔn)確度好,適用于河蝦中地西泮和奧沙西泮殘留量的測定。
關(guān)鍵詞: 超高效液相色譜-串聯(lián)質(zhì)譜法; 同位素內(nèi)標(biāo); 地西泮; 奧沙西泮; 全自動(dòng)固相萃取
地西泮,又叫安定,屬苯二氮卓類鎮(zhèn)靜催眠藥,具有鎮(zhèn)靜催眠,促生長等作用。地西泮還作為動(dòng)物增重促進(jìn)劑在水產(chǎn)品養(yǎng)殖行業(yè)中廣泛應(yīng)用;但因地西泮及其代謝物在水產(chǎn)品體內(nèi)殘留對人體的毒副作用,而備受人們關(guān)注[1-4]。目前,測定食品中地西泮及其代謝物殘留的方法主要包括酶聯(lián)免疫法[5-6]、氣相色譜法[7]、氣相色譜-質(zhì)譜聯(lián)用法[8-9]、液相色譜法[10-11]、液相色譜-質(zhì)譜聯(lián)用法[12-16]等。雖然前四種方法在一定程度上解決了食品中地西泮及其代謝物殘留檢測的問題,但仍存在一些局限性。酶聯(lián)免疫法易出現(xiàn)假陽性結(jié)果,而氣相色譜法、氣相色譜-質(zhì)譜聯(lián)用法和液相色譜法操作過程繁瑣且靈敏度較低,因此這些方法不適合作為最終的確證方法。同位素內(nèi)標(biāo)-液相色譜-質(zhì)譜聯(lián)用法因具有補(bǔ)償基質(zhì)效應(yīng)和提取過程損失、檢出限低、準(zhǔn)確度高、抗干擾能力強(qiáng)及樣品無需衍生化等優(yōu)點(diǎn),廣泛應(yīng)用于食品中地西泮及其代謝物的殘留檢測[17-19]。由于河蝦類樣品中含有色素及蛋白質(zhì)等復(fù)雜基質(zhì),采用傳統(tǒng)的固相萃取可以達(dá)到良好的凈化效果,但存在操作步驟繁瑣耗時(shí)等缺點(diǎn)。相比之下,全自動(dòng)固相萃取(SPE)具有可以自動(dòng)完成從活化、上樣、到淋洗、洗脫的全部工作,操作簡便,極大提高了樣品處理的效率[17-18]。
筆者建立了超高效液相色譜-串聯(lián)質(zhì)譜同時(shí)測定河蝦中地西泮和奧沙西泮殘留量的方法。采用全自動(dòng)MCX固相萃取小柱凈化,并運(yùn)用同位素內(nèi)標(biāo),對質(zhì)譜條件和色譜條件進(jìn)行了優(yōu)化,適用于河蝦中地西泮和奧沙西泮殘留量的測定。
1、 實(shí)驗(yàn)部分
1.1 主要儀器與試劑
超高壓液相色譜-串聯(lián)質(zhì)譜儀:TripleQuad-3500型,美國賽克斯公司。
超純水機(jī):Pure lab flex3型,英國威立雅有限公司。
渦旋振蕩器:Vortex-Genie2型,美國科學(xué)工業(yè)有限公司。
高速冷凍離心機(jī):TGL-20M型,湖南凱達(dá)科學(xué)儀器有限公司。
全自動(dòng)固相萃取儀:EXTRA型,上海屹堯儀器有限公司。
固相萃取柱:(1)MCX型、C18 型,500 mg(3 mL),德國CNW公司;(2)HLB型、MAX型、硅膠型,500 mg(3 mL),美國沃特世公司;(3)中性氧化鋁型、PEP-2 SPE型,500 mg(3 mL),天津博納艾杰爾科技有限公司。
地西泮標(biāo)準(zhǔn)溶液、奧沙西泮標(biāo)準(zhǔn)溶液、地西泮-D5標(biāo)準(zhǔn)溶液和奧沙西泮-D5標(biāo)準(zhǔn)溶液:質(zhì)量濃度均為100 µg/mL,標(biāo)準(zhǔn)物質(zhì)編號分別為1ST7102-100M-S114731、1ST8031-100M-S120001、1ST7102D5-100M-S126697、1ST8031-100M-S118659,天津阿爾塔科技有限公司。
乙腈、甲醇、甲酸:均為色譜純,德國默克公司。
河蝦樣品:屬于白絨河蝦類,又稱白絨蝦,市售。
1.2 溶液配制
混合標(biāo)準(zhǔn)中間溶液:準(zhǔn)確移取0.10 mL地西泮標(biāo)準(zhǔn)溶液和奧沙西泮標(biāo)準(zhǔn)溶液置于10 mL容量瓶中,用甲醇稀釋至標(biāo)線,制得地西泮和奧沙西泮的質(zhì)量濃度均為1 000 μg/L的混合標(biāo)準(zhǔn)中間溶液。
混合內(nèi)標(biāo)中間溶液:準(zhǔn)確移取0.10 mL地西泮-D5標(biāo)準(zhǔn)溶液和奧沙西泮-D5標(biāo)準(zhǔn)溶液置于10 mL容量瓶中,用甲醇稀釋至標(biāo)線。制得地西泮-D5和奧沙西泮-D5的質(zhì)量濃度均為1 000 μg/L的混合內(nèi)標(biāo)中間溶液。
系列混合標(biāo)準(zhǔn)工作溶液:分別準(zhǔn)確移取0.005、0.010、0.020、0.050、0.100 mL地西泮和奧沙西泮混合標(biāo)準(zhǔn)中間溶液置于10 mL容量瓶中,各加入0.010 mL混合內(nèi)標(biāo)中間溶液,用0.1%甲酸水溶液稀釋至標(biāo)線。制得地西泮和奧沙西泮的質(zhì)量濃度均分別為0.5、1.0、2.0、5.0、10 μg/L的系列混合標(biāo)準(zhǔn)工作溶液。該系列混合標(biāo)準(zhǔn)工作溶液中地西泮-D5和奧沙西泮-D5的質(zhì)量濃度均為10 μg/L。
1.3 儀器工作條件
1.3.1 色譜儀
色譜柱:Shim-pack GISS C18柱(50 mm×2.1 mm,1.9 μm,日本島津公司);進(jìn)樣體積:10.0 μL;柱溫:29 ℃;流動(dòng)相:A相為甲醇溶液,B相為0.1%(體積分?jǐn)?shù))甲酸溶液,流量為0.30 mL/min;洗脫方式:梯度洗脫,洗脫程序見表1。
表1 梯度洗脫程序
Tab. 1 Gradient elution program

1.3.2 質(zhì)譜儀
離子化電壓:5 500 V;離子源溫度:555 ℃;氣簾氣壓力:158.585 kPa;碰撞氣壓力:62.055 kPa;噴霧氣壓力、輔助加熱氣壓力:均為372.33 kPa;離子源:電噴霧離子源;掃描模式:正離子模式;數(shù)據(jù)采集模式:多反應(yīng)監(jiān)測模式。地西泮、奧沙西泮及內(nèi)標(biāo)的質(zhì)譜參數(shù)見表2。
表2 地西泮和奧沙西泮及內(nèi)標(biāo)的質(zhì)譜參數(shù)
Tab. 2 Diazepam and oxazepam and their intrinsic mass spectrum parameters

注:*表示定量子離子。
1.4 樣品處理
1.4.1 提取
參照SN/T 2113—2008《進(jìn)出口動(dòng)物源性食品中鎮(zhèn)靜劑類藥物殘留量的檢測方法 液相色譜-質(zhì)譜/質(zhì)譜法》確定樣品提取過程,流程圖如圖1所示。

圖1 河蝦樣品提取流程圖
Fig. 1 Flow chart of pretreatment of river shrimp samples
1.4.2 凈化
采用全自動(dòng)固相萃取(SPE)儀設(shè)定作業(yè)程序,具體程序見表3,利用MCX SPE柱進(jìn)行凈化。洗脫后,于40 ℃水浴中氮吹至近干。加入1.0 mL 0.1%甲酸溶液超聲溶解殘留物,過0.22 μm濾膜,濾液即為樣品溶液。
表3 全自動(dòng)固相萃取儀作業(yè)程序
Tab. 3 Automatic solid phase extractor action program

1.5 樣品測定
取樣品溶液,在1.3儀器工作條件下進(jìn)行測定,以內(nèi)標(biāo)法定量。
2、 結(jié)果與討論
2.1 質(zhì)譜條件的優(yōu)化
鑒于待測物的分子結(jié)構(gòu),選擇在正離子電離模式下,對質(zhì)量濃度為100 μg/L的地西泮和奧沙西泮及其同位素混合內(nèi)標(biāo)中間溶液進(jìn)行一級質(zhì)譜掃描。確定地西泮母離子峰(m/z 285.1)、奧沙西泮母離子峰(m/z 287.1)、地西泮-D5母離子峰(m/z 290.1)和奧沙西泮-D5母離子峰(m/z 292.1)。分別對上述母離子峰進(jìn)行二級質(zhì)譜掃描,找到地西泮兩個(gè)主要二級碎片離子對為m/z 285.1,193.0和m/z 285.1,154.0;奧沙西泮兩個(gè)主要二級碎片離子對為m/z 287.1,241.0和m/z 287.1,269.0;地西泮-D5一個(gè)主要二級碎片離子對為m/z 290.1,198.1和奧沙西泮-D5一個(gè)主要二級碎片離子對為m/z 292.1,246.1。地西泮和奧沙西泮分別選擇相對豐度較大的離子對m/z 285.1,193.0 和m/z 287.1,241.0 作為定量離子對,再對所有找到的離子對進(jìn)行質(zhì)譜參數(shù)的優(yōu)化,確定相應(yīng)的去簇電壓、碰撞電壓等參數(shù),得到較高靈敏度。
2.2 流動(dòng)相的選擇
鑒于目標(biāo)分析物的酸堿性和電噴霧離子源的特性,在GISS C18色譜柱上,考察了20 mmol/L乙酸銨溶液-甲醇、0.1%甲酸溶液-甲醇、純水-甲醇作為流動(dòng)相體系時(shí)對靈敏度的影響。結(jié)果表明,在河蝦加標(biāo)樣品中,20 mmol/L乙酸銨溶液-甲醇、純水-甲醇作為流動(dòng)相時(shí),目標(biāo)分析物的響應(yīng)值較低且峰形較差。0.1%甲酸溶液-甲醇的流動(dòng)相體系獲得了最佳的靈敏度。在此流動(dòng)相組成條件下,通過優(yōu)化梯度洗脫條件,得到的化合物色譜峰為尖銳窄峰且峰形對稱,因此最終確定0.1%甲酸-甲醇溶液作為流動(dòng)相。
2.3 全自動(dòng)SPE條件的優(yōu)化
2.3.1 SPE柱的選擇
為獲得最佳的凈化效果,結(jié)合待測目標(biāo)物的化學(xué)結(jié)構(gòu)特征,比較MCX柱、C18柱、HLB柱、MAX柱、硅膠柱、中性氧化鋁柱、PEP-2柱7種SPE柱對目標(biāo)分析物凈化效果的影響,以回收率比較凈化效果的優(yōu)劣。不同固相萃取柱的目標(biāo)物回收率如圖2所示,從圖2中可以看出,采用MCX柱進(jìn)行凈化,地西泮和奧沙西泮的回收率均高于采用其他6種SPE柱的回收率,因此采用MCX柱進(jìn)行凈化。
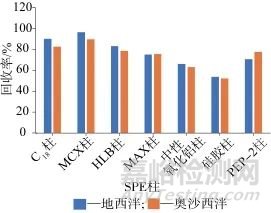
圖2 不同固相萃取柱的目標(biāo)物回收率
Fig. 2 Recoveries of target material in different solid phase extraction columns
2.3.2 洗脫液的選擇
鑒于目標(biāo)物是弱堿性化合物[19],在全自動(dòng)SPE裝置上采用MCX柱進(jìn)行凈化時(shí),分別比較了氨化乙酸乙酯和氨化甲醇作為洗脫液對回收率的影響。結(jié)果表明,以氨化乙酸乙酯作洗脫液時(shí),地西泮和奧沙西泮的回收率均低于40%;而當(dāng)用氨化甲醇作洗脫液時(shí),地西泮和奧沙西泮的回收率均較高。在此基礎(chǔ)上進(jìn)一步比較了甲醇中不同氨水添加體積分?jǐn)?shù)(0%、1%、3%、5%、7%、10%)作為洗脫液對回收率的影響,如圖3所示。從圖3中可以看出,甲醇中氨水添加體積分?jǐn)?shù)為3%時(shí),地西泮和奧沙西泮的回收率均高于95%,因此選擇甲醇中氨水添加體積分?jǐn)?shù)為3%作為洗脫液。

圖3 甲醇中氨水不同添加量對應(yīng)的目標(biāo)物回收率
Fig. 3 Recoveries of target material corresponding to different addition amount of ammonia water in methanol
2.4 專屬性試驗(yàn)
在1.3儀器工作條件下,對質(zhì)量濃度為10 μg/L的系列混合標(biāo)準(zhǔn)工作溶液進(jìn)行測定。地西泮和奧沙西泮的提取離子色譜圖如圖4所示,從圖4中可以看出,地西泮、奧沙西泮混合標(biāo)準(zhǔn)溶液的質(zhì)譜響應(yīng)值高,其峰形尖銳且對稱,地西泮、奧沙西泮的分子離子峰的相對保留時(shí)間分別是4.357、4.110 min。

圖4 地西泮和奧沙西泮的提取離子色譜圖
Fig. 4 Extraction ion chromatogram of diazepam and oxazepam
2.5 線性方程及檢出限
在1.3儀器工作條件下,對7個(gè)質(zhì)量濃度水平的系列混合標(biāo)準(zhǔn)工作溶液進(jìn)行測定。地西泮、奧沙西泮均以其定量離子對的峰面積和對應(yīng)內(nèi)標(biāo)離子對的峰面積的比值(y)為縱坐標(biāo),以標(biāo)準(zhǔn)溶液的質(zhì)量濃度和對應(yīng)內(nèi)標(biāo)的質(zhì)量濃度的比值(x)為橫坐標(biāo),繪制標(biāo)準(zhǔn)工作曲線,計(jì)算線性方程。參照HJ168—2020《環(huán)境監(jiān)測分析方法標(biāo)準(zhǔn)制訂技術(shù)導(dǎo)則》確定方法檢出限,即分別稱取7份粉碎勻漿后的河蝦樣品空白各2 g,均添加0.2 μg/kg的混合標(biāo)準(zhǔn)溶液,計(jì)算7次測定結(jié)果的標(biāo)準(zhǔn)偏差,以3倍標(biāo)準(zhǔn)偏差作為檢出限,以10倍標(biāo)準(zhǔn)偏差作為定量限。地西泮和奧沙西泮的線性范圍、線性方程、相關(guān)系數(shù)、檢出限及定量限見表4。由表4可知,地西泮、奧沙西泮的質(zhì)量分?jǐn)?shù)均在0.1~10.0 μg/kg范圍內(nèi)與色譜峰面積線性關(guān)系良好,相關(guān)系數(shù)均不小于0.999 3,地西泮、奧沙西泮的檢出限均為0.05 μg/kg,滿足檢測要求。
表4 地西泮和奧沙西泮的線性范圍、線性方程、相關(guān)系數(shù)、檢出限及定量限
Tab. 4 Linear range,linear equation,correlation coefficient,detection limit and quantitation limit of diazepam and oxazepam

2.6 加標(biāo)回收與精密度試驗(yàn)
分別稱取18份粉碎勻漿后的河蝦樣品空白各2 g,分別進(jìn)行3個(gè)濃度水平(檢出限、2倍檢出限、10倍檢出限)的樣品進(jìn)行加標(biāo)回收試驗(yàn),每種濃度平行制備各6份,在1.3儀器工作條件下進(jìn)樣測定,加標(biāo)回收與精密度試驗(yàn)結(jié)果見表5。
表5 加標(biāo)回收與精密度試驗(yàn)結(jié)果
Tab. 5 Results of standard recoveries and precision test

由表5可知,地西泮三個(gè)水平的加標(biāo)平均回收率分別為89.5%、94.0%、93.6%,測定結(jié)果的相對標(biāo)準(zhǔn)偏差(RSD)分別為5.0%、3.6%、2.3%(n=6)。奧沙西泮三個(gè)水平的加標(biāo)回收率分別為91.1%、92.5%、83.1%,測定結(jié)果的相對標(biāo)準(zhǔn)偏差(RSD)分別為7.8%、2.4%、4.5%(n=6)。表明該方法準(zhǔn)確度、精密度較高。
3、 結(jié)語
建立了超高效液相色譜-串聯(lián)質(zhì)譜同時(shí)測定河蝦中地西泮和奧沙西泮殘留量的方法。采用全自動(dòng)MCX固相萃取小柱凈化,操作簡潔,應(yīng)用同位素內(nèi)標(biāo)降低基質(zhì)效應(yīng)和減少提取過程損失。該方法準(zhǔn)確度高、靈敏度好,可適用于河蝦中地西泮和奧沙西泮殘留量的大批量快速測定。
參考文獻(xiàn):
1 楊嘉麗,林詩婷.液相色譜-串聯(lián)質(zhì)譜法測定樣品中地西泮殘留量的不確定度分析[J].食品安全導(dǎo)刊,2023(1):114.
YANG Jiali,LIN Shiting. Uncertainty analysis of diazepam residues by liquid chromatography-tandem mass spectrometry[J]. China Food Safety,2023(1):114.
2 王守英,孔聰,楊光昕,等.上海市售水產(chǎn)品地西泮及去甲地西泮殘留調(diào)查分析[J].農(nóng)產(chǎn)品質(zhì)量與安全,2020(3):31.
WANG Shouying,KONG Cong,YANG Guangxin,et al. Diazepam and nordazepam residue in the aquatic product from market in Shanghai[J]. Quality and Safety of Agro-products,2020(3):31.
3 陳曉紅,林夢,金米聰.生物樣品中鎮(zhèn)靜類藥物檢測的研究進(jìn)展[J].理化檢驗(yàn)(化學(xué)分冊),2020,56(5):612.
CHEN Xiaohong,LIN Meng,JIN Micong. Research progress on detection of sedative drugs in biological samples[J]. Physical Testing and Chemical Analysis (Part B:Chemical Analysis),2020,56(5):612.
4 丁宇琦,朱價(jià),梁晶晶,等.動(dòng)物源性食品中地西泮殘留量的檢測方法研究[J].浙江大學(xué)學(xué)報(bào)(理學(xué)版),2019,46(3):339.
DING Yuqi,ZHU Jia,LIANG Jingjing,et al. Research on methods for determination of diazepam residue in animal original food[J]. Journal of Zhejiang University (Science Edition),2019,46(3):339.
5 桑麗雅,陳笑笑,王揚(yáng),等.基于免疫磁珠的膠體金免疫層析法快速檢測水產(chǎn)品中地西泮殘留[J].食品工業(yè)科技,2020,41(20):255.
SANG Liya,CHEN Xiaoxiao,WANG Yang,et al. Rapid Determination of diazepam residue in aquatic products by immunomagnetic beads-colloidal gold immunochromatography assay[J]. Science and Technology of Food Industry,2020,41(20):255.
6 萬宇平,吳小勝,臧永軍,等.飼料中地西泮殘留的酶聯(lián)免疫檢測試劑盒研制[J].貴州畜牧獸醫(yī),2018,42(6):1.
WAN Yuping,WU Xiaosheng,ZANG Yongjun,et al. Development of an enzyme- linked immunosorbent assay kit for the detection of diazepam residues in feed[J]. Guizhou Journal of Animal Husbandry & Veterinary Medicine,2018,42(6):1.
7 張玉潔,張素霞,程林麗,等. GC-μECD法快速檢測豬肉地西泮殘留[J].安徽農(nóng)業(yè)科學(xué),2009,37(18):8 316.
ZHANG Yujie,ZHANG Suxia,CHENG Linli,et al. Quick determination of diazepam in pork by gas chromatograph-microelectron capture detection[J]. Journal of Anhui Agricultural Sciences,2009,37(18):8 316.
8 馬麗莎,尹怡,謝文平. QuEChERS-氣相色譜質(zhì)譜法快速測定水產(chǎn)飼料中地西泮殘留[J].中國漁業(yè)質(zhì)量與標(biāo)準(zhǔn),2022,12(3):17.
MA Lisha,YIN Yi,XIE Wenping,et al. Fast determination of diazepam in aquatic feed by gas chromatography-mass spectrometry combined with QuEChERS[J]. Chinese Fishery Quality and Standards,2022,12(3):17.
9 譚貴良,趙天珍,王文林,等.氣相色譜-質(zhì)譜法同時(shí)測定臘腸中7種鎮(zhèn)靜劑類藥物殘留[J].現(xiàn)代食品科技,2014,30(2):274.
TAN Guiliang,ZHAO Tianzhen,WANG Wenlin,et al. Determination of seven sedative residues in sausage by gas chromatography-mass spectrometry[J]. Modern Food Science & Technology,2014,30(2):274.
10 徐碩,金鵬飛,鄺詠梅,等. HPLC法檢測中成藥及保健品中非法添加的10種鎮(zhèn)靜催眠類藥物[J].西北藥學(xué)雜志,2019,34(2):181.
XU Shuo,JIN Pengfei,KUANG Yongmei,et al. Simultaneous determination of 10 sedative hypnotics illegally adulterated in Chinese patent medicines and health foods by HPLC[J]. Northwest Pharmaceutical Journal,2019,34(2):181.
11 楊青軍,王華,高延甲,等.替代對照品法在鎮(zhèn)靜安神類藥物HPLC快速檢驗(yàn)方法中的應(yīng)用[J].中國現(xiàn)代應(yīng)用藥學(xué),2015,32(11):1 376.
YANG Qingjun,WANG Hua,GAO Yanjia,et al. Application of substitution method of reference substance in the rapid determination of sedative drugs by HPLC[J]. Chinese Journal of Modern Applied Pharmacy,2015,32(11):1 376.
12 馮靜,鄒淼,陳曦,等.超高效液相色譜-串聯(lián)質(zhì)譜法檢測牛肉中16種鎮(zhèn)靜劑類藥物殘留[J].食品安全質(zhì)量檢測學(xué)報(bào),2019,10(10):3 091.
FENG Jing,ZOU Miao,CHEN Xi,et al. Determination of 16 sedative residues in beef by ultra high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Food Safety and Quality,2019,10(10):3 091.
13 孫雷,張?bào)P,徐倩,等.超高效液相色譜-串聯(lián)質(zhì)譜法檢測豬肉和豬腎中殘留的l0種鎮(zhèn)靜劑類藥物[J].色譜,2010,28(1):38.
SUN Lei,ZHANG Li,XU Qian,et al. Determination of ten sedative residues in pork and kidney by ultra performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography,2010,28(1):38.
14 ZHI L,JOE S,ANNE R,et al. The simultaneous determination of diazepam and its three metabolites in dog plasma by high-performance liquid chromatography with mass spectroscopy detection[J]. Journal of Pharmaceutical and Biomedical Analysis,2001,26(2):321.
15 于慧娟,錢蓓蕾,黃冬梅,等.液相色譜串聯(lián)質(zhì)譜法測定大菱鲆和鱖魚體中地西泮及其代謝物殘留的研究[J].中國漁業(yè)質(zhì)量與標(biāo)準(zhǔn),2011,1(1):54.
YU Huijuan,QIAN Beilei,HUANG Dongmei,et al. Determination of diazepam and its residue in turbot and mandarinfish by high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Fishery Quality and Standards,2011,1(1):54.
16 張璇,楊光昕,孔聰,等.高效液相色譜-串聯(lián)質(zhì)譜法測定水產(chǎn)品中鎮(zhèn)靜劑及其代謝物殘留[J].分析化學(xué),2021,49(3):460.
ZHANG Xuan,YANG Guangxin,KONG Cong,et al. Determination of tranquilizer and their metabolites residues in aquatic products by high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry,2021,49(3):460.
17 江恩源,朱國強(qiáng),勞哲,等.牛肉和牛肝中4種β-受體激動(dòng)劑類藥物殘留量的全自動(dòng)固相萃取-同位素內(nèi)標(biāo)-超高壓液相色譜串聯(lián)質(zhì)譜測定法[J].職業(yè)與健康,2022,38(13):1 761.
JIANG Enyuan,ZHU Guoqiang,LAO Zhe,et al. Determination of four kinds of β-agonists in beef and bovine liver with automated solid phase extraction isotope internal standards by ultra-high-pressure liquid chromatography-tandem triple quadrupole mass spectrometry[J]. Occupation and Health,2022,38(13):1 761.
18 徐瀟穎,趙超群.梁晶晶,等.全自動(dòng)固相萃取-高效液相色譜-串聯(lián)質(zhì)譜法測定豆芽中15種喹諾酮類藥物的殘留量[J].理化檢驗(yàn)(化學(xué)分冊),2020,56(5):583.
XU Xiaoying,ZHAO Chaoqun,LIANG Jingjing,et al. HPLC-MS/MS determination of residual amounts of 15 quinolones in bean sprouts with automated solid phase extraction[J]. Physical Testing and Chemical Analysis (Part B:Chemical Analysis),2020,56(5):583.
19 張爍,周爽,陳達(dá)煒,等.畜肉中10種鎮(zhèn)靜劑殘留的超高效液相色譜-串聯(lián)質(zhì)譜測定方法[J].分析測試學(xué)報(bào),2014,33(11):1 213.
ZHANG Shuo,ZHOU Shuang,CHEN Dawei,et al. Determination of ten sedative residues in livestock products by ultra high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Instrumental Analysis,2014,33(11):1 213.
引用本文: 江恩源,朱國強(qiáng),韋麗麗,等 . 超高效液相色譜-串聯(lián)質(zhì)譜法同時(shí)測定河蝦中地西泮和奧沙西泮殘留量[J]. 化學(xué)分析計(jì)量,2024,33(11):107. (JIANG Enyuan, ZHU Guoqiang, WEI Lili, et al. Simultaneous determination of diazepam and oxazepam residues in river shrimp by ultra high performance liquid chromatography-tandem mass spectrometry[J]. Chemical Analysis and Meterage, 2024, 33(11): 107.)

來源:化學(xué)分析計(jì)量


