您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2024-12-29 18:49
摘要
目的 通過考察與腮腺炎病毒原液直接接觸的一次性儲液袋在凍存情況下的浸出物水平,評估使用一次性儲液袋凍存腮腺炎病毒原液的安全性。
方法 將使用一次性儲液袋和標準肖特瓶盛裝的腮腺炎病毒模擬料液放置于-60 ℃以下冰箱保存,分別于0、6、12、15個月各取出3份樣品,以提取物研究中檢出的丙酮、叔丁醇和異丙醇作為靶標物質進行浸出物檢測及安全劑量分析。
結果 丙酮、叔丁醇和異丙醇在保存周期中均于15個月時出現檢出最高峰,浸出物含量分別達到415.02、275.82和936.92 μg/L,且各檢測時間節點一次性儲液袋浸出物含量均低于允許日接觸量或安全評估閾值。
結論 使用一次性儲液袋凍存的腮腺炎病毒模擬料液的浸出物含量未超出安全范圍,安全性風險小。
腮腺炎病毒屬于副黏病毒科,為單股RNA病毒,不耐酸且易被脂溶劑滅活。國內傳統的腮腺炎病毒疫苗原液制備工藝采用原代雞胚細胞,經由細胞培養、病毒接種及收獲病毒液合并制得。腮腺炎病毒對熱敏感,極不穩定,目前國內主要采用玻璃瓶凍存腮腺炎病毒原液以解決上述問題,但玻璃瓶存在密閉性差、空間占用大、轉運不便且融化過程破損嚴重等弊端。
一次性聚乙烯儲液袋是目前生物行業廣泛應用于盛裝液體的容器,近幾年開始被用于疫苗原液凍存,該品可以有效解決玻璃瓶使用過程中的諸多不便。作為直接接觸藥品的容器,一次性儲液袋對藥品安全性、有效性及穩定性的影響受到藥品行業及藥監部門的關注。
腮腺炎病毒原液需要長期低溫保存于容器中,浸出物有可能隨時間逐漸增加。本研究將在容器容量、表面積和儲液量符合實際的前提下,通過分時檢測腮腺炎病毒模擬料液的相關浸出物,評估一次性儲液袋儲存腮腺炎病毒原液時的浸出物含量,驗證其安全性和實用性。
1、材料與方法
1.1主要試劑
199培養基購自美國Gibco公司,碳酸氫鈉(分析純級)和人血白蛋白(藥品)購自國藥集團化學試劑有限公司。
丙酮、叔丁醇、異丙醇標準溶液購自美國Accustandard公司,10 mg/ml水溶液。內標物:氘代乙醇-d6(CAS:1516-08-1)購自比利時Acros Organics公司。
1.2儀器與設備
25 ml肖特試劑瓶和50 ml一次性儲液袋、用于保存樣品的超低溫冰箱(可設置至-60 ℃以下并穩定運行)均購自賽默飛世爾科技(中國)有限公司(賽默飛)。Shimadzu QP2010ultra型氣相色譜-質譜聯用(gas chromatography-mass spectrometry,GC-MS)儀由清華大學分析中心提供,配備有TR-WAXMS GC色譜柱(購自美國Thermo Scientific公司,30 m×0.25 mm×0.25 μm),進樣口250 ℃,載體為高純氦氣,流量為1 ml/min,分流比為10。升溫程序:35 ℃保持4 min。離子源200 ℃,接口250 ℃。
1.3樣品盛裝容器
1.3.1 空白組 采用25 ml肖特試劑瓶盛裝。該肖特試劑瓶的耐化學性符合ISO3585和4796標準,目前尚無此類容器存在丙酮、叔丁醇和異丙醇溶出或潛在溶出物的報道。
1.3.2 試驗組 采用50 ml一次性儲液袋。該規格一次性儲液袋與生產使用的20 L大容量儲液袋所采用的材質均為聚乙烯CX5-14膜。
1.4樣品準備
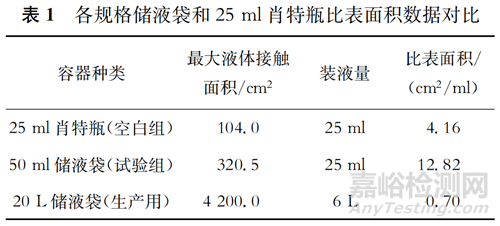
1.4.1 各容器比表面積對比 由表1可見,50 ml儲液袋的比表面積最大,為12.82 cm2/ml,處于最具有挑戰性的試驗環境中,而實際生產中使用的20 L儲液袋的比表面積為0.70 cm2/ml,僅為50 ml儲液袋比表面積的約1/18。將50 ml儲液袋作為浸出物試驗的樣品袋,得出的試驗結論最具有代表性和權威性,對于判定實際生產的安全性更可靠。
1.4.2 模擬料液配制與裝載 模擬料液含注射用水、199培養基、人血白蛋白、碳酸氫鈉,為腮腺炎病毒原液的最終培養液體系,與生產用原液配液比一致,除不含腮腺炎病毒外所有成分組成無任何差異;并通過加入碳酸氫鈉調節pH至與實際腮腺炎病毒原液一致。空白組于25 ml肖特試劑瓶中裝入25 ml模擬料液,試驗組于50 ml一次性儲液袋中裝入25 ml模擬料液。
1.4.3 浸出物樣品準備及送檢 空白組和試驗組均放入-60 ℃以下冰箱凍存,分別于0、6、12和15個月各取出3份送樣檢測。樣品運輸方式采用干冰運輸,保證運輸過程中樣品無解凍。檢測前將樣品容器置于水浴解凍(水溫30 ℃以下),待樣品完全解凍后,輕柔搖晃使料液完全混勻。委托賽默飛聯合北京清華大學分析中心進行丙酮、叔丁醇和異丙醇含量檢測,每份樣品檢測1次。浸出值的計算方式為將試驗組檢測均值減去空白組檢測均值,以去除樣本中本來含有的物質的影響,如差值為負數可認為試驗組對照于空白組無浸出,相對浸出數值計為0。
1.5浸出物檢測及安全劑量分析
1.5.1 浸出物檢測 使用GC-MS儀對送檢的空白組和試驗組樣品中的丙酮、叔丁醇和異丙醇進行含量檢測,檢測中的儀器精度和準確度達到分析痕量揮發性物質的檢測要求。
1.5.2 安全劑量分析 根據ICH Q3C(R8)《雜質:殘留溶劑的指導原則》中常用有機溶劑分類及殘留限度的要求進行殘留毒性分析,評估相關浸出物的安全劑量。
2、結果
2.1浸出物試驗結果
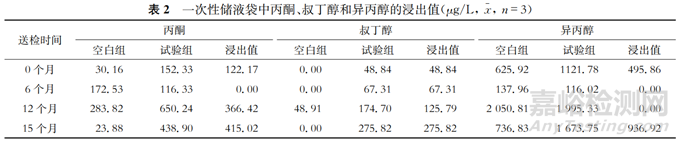
由表2可見,到部分節點后數據呈現負增長,而浸出值的負增長并不一定是一次性儲液袋中浸出物含量的減少。測試樣品在0—15個月的保存周期中(該測試周期已覆蓋腮腺炎病毒原液12個月的保存周期),丙酮、叔丁醇和異丙醇均于15個月時出現檢出最高峰,浸出物含量分別達到415.02、275.82和936.92 μg/L,可以判斷在整個保存周期中丙酮、叔丁醇和異丙醇的浸出物含量呈現波動增加的趨勢,雖然在中間部分檢測節點出現了未增長的情況,但在保存至15個月的最終檢測節點時,丙酮、叔丁醇和異丙醇的浸出值與0個月的浸出值相比均大幅增長。從整個保存周期和檢測周期判斷丙酮、叔丁醇和異丙醇3種物質的浸出值是有所上升的(見表2)。
2.2浸出物安全劑量分析
根據ICH Q3C(R8)《雜質:殘留溶劑的指導原則》,丙酮和異丙醇均為3類溶劑,叔丁醇為2類溶劑。殘留的3類溶劑含量依照原則需低于0.5%,0.5%的溶劑含量相當于5 000 μg/L,而該數值遠遠高于本試驗各時間節點中檢測出的3類溶劑的最大測試濃度(非均值)721.51、321.00、2 040.35 μg/L。因叔丁醇為2類溶劑,故在此基礎上以更能反映藥物安全性的允許日接觸量(permitted daily exposure,PDE)來進行評估,并以終產品中樣品的每日最大注射量為0.5 ml計算最大攝入量。
本次試驗中PDE按照較嚴格的靜脈注射藥品的要求進行計算,數據來源于化學物質毒性數據庫。由表3可知,試驗中檢出的3種浸出物成分的最大攝入量均低于相應的PDE。實際使用中,相關疫苗產品是由病毒原液經稀釋配制而成,這意味著即使在更嚴格的情況下,各浸出物的最大攝入量都要遠遠低于PDE的限值。使用一次性儲液袋并不會有安全性隱患。

3、討論
一次性儲液袋與藥品應具有良好的相容性,本研究遵循《化學藥品注射劑與塑料包裝材料相容性研究技術指導原則(試行)》開展部分相容性研究,相關研究均符合國際通用標準。
檢測中方法的檢測靈敏度為μg/L,定量方法采用選擇性離子監測方法定量,定量離子分別為丙酮(43)、叔丁醇(59)、異丙醇(45)、氘代乙醇(33),3種待測物的線性范圍為質量分數(2~100)×10-8。采用內標法定量,氘代乙醇為質量分數5×10-7。另外,氘代乙醇和異丙醇的保留時間相近(在質譜圖上峰重合),不過定量離子不同且非相互的特征離子,不影響定量。由于試驗中使用的GC-MS儀定量限為質量分數2×10-7,為較小的數值,因此相較于數值較大的數據,本次試驗中的檢出數據的浮動性相對較大。數值級別較小,更加證明了浸出物含量的數量級遠未達到可以造成不良影響的程度。
由于丙酮、叔丁醇和異丙醇作為提取研究中確定的研究成分,均存在吸附和蒸發作用的影響,因此檢測周期中浸出物檢出的數值未必一定會隨著保存時間增加而增加,本次試驗組的一次性儲液袋為加蓋密閉容器并在蓋子處纏繞絕緣膠帶進行密閉保護,在進行檢測前不進行任何拆卸外包的動作,檢測過程中也進行樣品的搖勻,最大程度避免了吸附和蒸發作用對本次試驗的容器影響,檢測數據可信度高。
本次試驗中,丙酮、叔丁醇、異丙醇3種檢出成分按產品每日最大注射量0.5 ml進行計算,檢測值均低于歐洲藥監局推薦的1.5 μg/d的安全性閾值。同時通過USP<88>動物體內試驗也確定了溶出物在大劑量注射方面的安全性。
上海生物制品研究所有限責任公司疫苗二室在進行儲液袋相容性試驗的同期也進行了實際儲存原液及原液配制成品的相關性研究,穩定性研究顯示使用一次性儲液袋凍存腮腺炎病毒原液在規定的有效期內可確保符合質量標準,甚至原液保存至超效期后仍符合腮腺炎病毒原液的滴度標準,與使用原1 L玻璃瓶無明顯差異,利用上述超效期原液配制的麻腮風聯合減毒活疫苗成品在超保存效期的各項時間節點的檢測項目均符合企業標準。即一次性儲液袋對于保存腮腺炎病毒原液在安全性、有效性及穩定性方面均有很好的保障,可以替代1 L玻璃瓶作為腮腺炎病毒原液的保存容器進行最多12個月的凍存。
另外,提升單個容器的凍存裝量可保證產品質量更加穩定均一,縮短制凍時間可減少病毒滴度的損耗,相較于傳統1 L玻璃瓶的手工制凍方式,儲液袋的機器制凍方式可減少對終產品質量產生的不利影響,這也成為一次性儲液袋替代1 L玻璃瓶作為腮腺炎病毒原液保存容器的一大優勢。
引用本文:陳曉望, 楊文震, 周鋒, 等. 一次性儲液袋凍存腮腺炎病毒原液的浸出物研究 [J]. 國際生物制品學雜志, 2024, 47(5): 281-284.

來源:國際生物制品學雜志


