您當前的位置:檢測資訊 > 實驗管理
嘉峪檢測網 2024-12-12 08:58
同源重組法質粒構建在基因功能研究、蛋白表達和純化的等方面具有廣泛的應用。內容包括了基因的敲除、敲低以及過表達等等,用于研究基因的功能、表達調控機制以及對細胞生理過程和表型的影響。另外通過優化啟動子、核糖體結合位點等表達元件,以及選擇合適的宿主細胞,利用同源重組法構建表達載體,使目的蛋白在宿主細胞中大量表達,從而達到目的蛋白表達和純化的目的。

通過同源重組構建重組 MVA 載體
相較于傳統酶切傳統酶切法依賴于限制性內切酶對DNA的特異性切割而言,同源重組法質粒構建基于DNA分子間的同源序列進行重組。因此這里主要介紹同源重組法質粒構建的實驗步驟和注意事項等。
一、流程圖
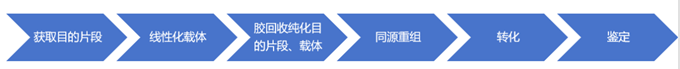
二、實驗步驟
1.獲取插入目的片段:
(1)引物設計:在插入片段正反向擴增引物的5’端引入線性化載體兩末端同源序列,使擴增后的插入片段5'和3'最末端分別帶有和線性化克隆載體兩末端對應一致的同源序列,長度一般為15-20bp,不包括酶切位點。
引物設計原則:同源臂+酶切位點+特異性引物(目的片段的一段序列),計算退火溫度時只計算基因特異性擴增序列的Tm值,引入的同源序列和酶切位點不參與計算。
此時可以借助SnapGene軟件進行協助,從NCBI獲取到自己基因的目的片段序列導入SnapGene,在添加同源臂和酶切位點會更加直觀,同時可以看見引物對的Tm值。
(2)PCR擴增:使用高保真聚合酶擴增插入片段,無需考慮產物末端有無A尾。為確保最優條件,可先設置梯度PCR確定最佳退火溫度,再根據高保真聚合酶的特性配置PCR體系,并依據擴增片段的大小設置合適的延伸時間,確定最佳的PCR條件。
2.獲取線性載體:
(1)選擇克隆位點:挑選合適的克隆位點對載體進行線性化,優先選擇無重復序列且載體克隆位點上下游20bp區域內GC含量在40%-60%之間的位點。
(2)選擇線性化方式:可采用限制性內切酶消化或反向PCR擴增。使用限制性內切酶消化時,推薦雙酶切方法使載體線性化完全,可以保證載體線性化完全;若使用單酶切線性化,則需適當延長酶切時間以減少環狀質粒殘留。而采用反向PCR擴增制備線性化載體時,要使用高保真聚合酶進行擴增,減少擴增突變的引入。
3.膠回收純化:
根據載體和插入片段的大小確定相應濃度的膠進行膠回收。膠回收完成后瓊脂糖凝膠電泳驗證回收產物,用分光光度計(如 Nanodrop)檢測插入片段和線性化載體的濃度以定量。
4.重組反應:
(1)稀釋:計算重組反應所需的線性化載體和插入片段所需DNA量,并進行稀釋擴大吸取量,確保各組分加入量不低于1ul。
(2)配置反應體系:冰上配置反應體系,用移液器輕輕吸打混勻,短暫離心將反應液收集至管底,另外酶置于冰上保存并最后加入。
(3)反應:將反應體系置于PCR儀器中,37℃反應30min,然后降至4℃或立即置于冰上冷卻。重組產物可于-20℃存放一周,待需要時解凍轉化。
5.重組產物轉化:
(1)解凍感受態細胞:冰上解凍感受態細胞,如常用DH5α感受態細胞。
(2)加入重組產物:取適量重組產物加入到感受態細胞中,輕輕混勻,冰上靜置30min。需注意重組產物轉化體積最多不應超過所用感受態細胞體積的1/10。
(3)熱激與復蘇:42℃水浴熱激45s后,立即置于冰上冷卻3min,再加入新鮮LB培養基,37℃,200rpm搖菌復蘇1h。
(4)涂板培養:將菌液離心,棄掉部分上清,用剩余培養基將菌體重懸,用無菌涂布棒在含有正確抗性的平板上輕輕涂勻,37℃培養箱中倒置培養12~16h。
6.重組反應產物鑒定:
(1)菌落PCR鑒定:挑取LB板上的單克隆若干個進行菌落PCR鑒定,擴增引物盡量選擇載體部分序列上的引物,根據擴增產物的大小和使用的酶確定延伸時間和PCR程序,瓊脂糖凝膠電泳檢測克隆正確時應有長度略大于插入片段大小的條帶出現。
(2)測序鑒定:對菌落PCR鑒定為陽性的菌落,可進一步接種培養后提取質粒進行酶切鑒定或者直接測序鑒定,以確保重組質粒的準確性。
三、注意事項
(1)引物設計:同源臂的長度一般為15-20bp,且GC含量應在40%-60%之間;計算引物Tm值時,僅考慮特異性引物部分,不包括同源臂和酶切位點。若引物長度超過40bp,在引物合成時可選用PAGE純化方式,以提高陽性克隆率。
(2)模板選擇:進行PCR擴增插入片段時,若目的片段較難擴增,可先使用不帶同源臂的引物克隆目的片段,再以膠回收產物為模板,用帶有同源臂的引物進行二次PCR擴增,但要注意此方法可能會引入較多突變。
(3)酶切與線性化:使用限制性內切酶進行載體線性化時,要確保酶切完全,可通過延長酶切時間或采用雙酶切方法來實現。若使用單酶切線性化載體,需注意原生環狀質粒殘留可能導致轉化不準確 。
(4)片段純化:膠回收過程中要使用新的刀片,防止外源DNA污染。同時,要確保膠回收產物的質量和濃度,以便后續準確計算使用量。
(5)比例與用量:嚴格按照載體與插入片段的最適摩爾比1:2來計算和使用兩者的量,以提高重組效率。若使用未經純化的線性化克隆載體和插入片段擴增產物,其加入總體積應不超過反應體系體積的1/5。
(6)重組反應條件:重組反應需在冰上配置反應體系,移液器輕輕吸打混勻,避免振蕩。反應溫度和時間要嚴格控制,一般為37℃反應30min左右,反應時間不足或過長都可能降低克隆效率。
(7)轉化過程:感受態細胞應在冰上解凍,加入重組產物后要輕輕混勻,避免損傷細胞。熱激時間和溫度要準確把握,熱激后需迅速置于冰上冷卻。此外,轉化產物的涂布量也要適中,過多或過少都可能影響陽性克隆的篩選,此時,可以設置涂布的量和濃度。
(8)鑒定環節:菌落PCR鑒定時,要選擇合適的引物和PCR程序,確保鑒定結果的準確性。對于初步鑒定為陽性的菌落,最好進行測序鑒定,以最終確定重組質粒的正確性。

來源:實驗老司機


