您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-06-03 09:34
更多醫藥技術資訊,請點擊醫藥專欄:http://drug.anytesting.com/ 歡迎關注文末微信公眾號:藥研檢測drugtest
「 本文共:15條資訊,閱讀時長約:3分鐘 」
今日頭條
科興新冠疫苗進WHO緊急使用清單。世衛組織(WHO)1日宣布,將北京科興中維研制的新冠滅活疫苗克爾來福列入“緊急使用清單”。WHO建議科興疫苗用于18歲及以上成年人,采用兩劑接種、間隔時間為2至4周。數據顯示,該疫苗對預防出現新冠癥狀的有效率為51%,對預防新冠重癥和入院治療的有效率達100%。這是我國第二個被WHO列入緊急使用清單的新冠疫苗。
國內藥訊
1.上海盟科抗菌新藥獲批上市。NMPA通過優先審評審批程序,批準盟科藥業1類創新藥康替唑胺片(優喜泰)上市,用于治療對康替唑胺敏感的金黃色葡萄球菌(甲氧西林敏感和耐藥的菌株)、化膿性鏈球菌或無乳鏈球菌引起的復雜性皮膚和軟組織感染。康泰唑胺(contezolid,MRX-I)是下一代噁唑烷酮類抗菌藥,此前已獲FDA授予治療急性細菌性皮膚和軟組織感染的快速通道資格。
2.澤布替尼全球Ⅲ期頭對頭研究數據公布。百濟神州在EHA2021會議上公布BTK抑制劑百悅澤(澤布替尼)對比伊布替尼用于治療成年復發或難治性慢性淋巴細胞白血病(CLL)或小淋巴細胞淋巴瘤(SLL)患者的頭對頭全球Ⅲ期臨床ALPINE積極數據。在中位隨訪15個月時,澤布替尼取得更高的ORR(78.3%vs62.5%);同時顯示出更具優勢的12個月PFS(95%vs84%),顯著降低疾病進展風險60%;而且,在患者中引起房顫的風險更低(2.5%vs10.1%),具統計學意義。
3.復宏漢霖創新CD73單抗獲FDA臨床許可。復宏漢霖自主研發的抗體新藥HLX23(重組抗CD73全人源單克隆抗體注射液)的臨床試驗申請獲FDA批準,擬開發用于晚期實體瘤的治療。HLX23可與癌細胞表面的CD73特異性結合,抑制CD73核苷酸酶功能和促進CD73內吞,抑制腫瘤生長。臨床前藥理學研究、藥代動力學研究及安全性研究表明,HLX23在動物體內的耐受性和安全性良好。全球范圍內尚未有該靶點藥物獲批上市。
4.再鼎引進KRAS抑制劑大中華區權益。再鼎醫藥與Mirati Therapeutics公司達成合作和許可協議,獲得Mirati 開發的小分子KRASG12C抑制劑adagrasib在大中華區研究、開發、生產及獨家商業化權益。adagrasib已在非小細胞肺癌、結直腸癌、胰腺癌和其他KRASG12C突變的實體瘤中顯示出單藥療效。根據協議,Mirati將獲得6,500萬美元的預付款,可能高達2.73億美元的額外開發、注冊和銷售里程碑付款,以及產品的銷售分成。
5.華東醫藥引進GLP-1/GIPR雙靶點降糖藥。華東醫藥宣布與日本SCOHIA公司達成合作,以400萬美元首付款和最高2400萬美元的開發、注冊和銷售里程碑付款獲得了處于臨床I期的GLP-1/GIPR雙靶點激動劑降糖藥SCO-094在中國、韓國、澳大利亞等25個亞太國家和地區(不含日本)的獨家開發、生產及商業化權益。目前在國內,除禮來Tirzepatide外,尚未有同靶點產品進入臨床。
國際藥訊
1.Alkermes抗精神病復方藥獲FDA批準上市。FDA批準Alkermes公司復方片劑Lybalvi(ALKS 3831)上市,用于治療成人精神分裂癥和雙相I型障礙(bipolar I disorder)。Lybalvi是由奧氮平(olanzapine)和samidorphan組成的復方片劑,它能在維持奧氮平療效的同時減輕它增加患者體重的代謝異常副作用。在一項Ⅲ期臨床ENLIGHTEN-2中,與對照組相比,Lybalvi組6個月時患者的體重增加的平均百分比表現出統計學意義的顯著降低(p=0.003)。
2.楊森BCMA/CD3雙抗獲FDA突破性療法認定。FDA授予楊森即用型BCMA/CD3雙特異性抗體teclistamab突破性療法認定,用于治療復發或難治性多發性骨髓瘤患者(R/R MM)。今年早些時候,teclistamab還獲得歐盟EMA頒發的優先藥物資格(PRIME)。在一項Ⅰ期MajesTEC-1研究中,在中位隨訪時間為7.1個月時,85%的緩解患者仍然在繼續接受治療。這項研究的最新結果將在ASCO2021年會上公布。
3.DMD創新療法達到關鍵性臨床終點。Santhera公司與ReveraGen BioPharma聯合開發的“first-in-class”類固醇藥物vamorolone在治療杜氏肌營養不良癥(DMD)的關鍵性Ⅱb期臨床中達到主要終點和多項關鍵性次要終點。Vamorolone顯著提高患者從仰臥姿態站起來的速度,6 mg/kg/day劑量組所需時間從6.0秒縮短到4.6秒,而安慰劑組這一時間從5.4秒增加到5.5秒;vamorolone也顯著改善患者6分鐘步行測試(6-MWT)指標;而且與prednisone相比,vamorolone引起的治療相關不良事件數目更少。預計明年第一季度向FDA遞交新藥申請,并尋求優先審評資格。
4.賽諾菲停止venglustat關鍵II/III期腎病試驗。賽諾菲日前宣布正在停止GCS抑制劑venglustat治療常染色體顯性多囊腎病的II/III期試驗。venglustat是一種通過抑制鞘糖脂異常積累來減緩疾病進展的新型分子。在獨立分析中,趨勢顯示使用該分子治療并沒有導致總腎臟體積增長率臨床意義的降低。此外,與venglustat相關的鞘糖脂的減少可能對腎臟囊腫的生長沒有顯著的預防作用。
5.安進聯手協和麒麟開發首創OX40單抗。安進與協和麒麟公司就一款潛在“first-in-class”OX40單抗KHK4083達成研發許可合作。KHK4083是一款擬用于治療特應性皮炎的臨床后期在研產品。根據協議,安進將負責KHK4083在日本以外全球市場的開發、制造和商業化,協和麒麟則保留日本市場的所有權利;協和麒麟將獲得4億美元的預付款、可能高達8.5億美元的里程碑付款以及產品的銷售提成。安進還將探索KHK4083用于其他自身免疫疾病的潛力。
6.諾和諾德聯合Heartseed開發心力衰竭干細胞療法。Heartseed公司與諾和諾德就Heartseed開發擬用于心力衰竭的干細胞療法HS-001達成合作和許可協議。根據協議,諾和諾德將獲得該新藥除日本以外全球范圍內開發、制造和商業化權利。Heartseed將保留在日本獨家開發HS-001的權利,兩家公司將在日本共同商業化該產品。Heartseed將獲得總額達5.98億美元的付款,其中包括5500萬美元的預付款和近期里程碑付款,Heartseed還將有資格獲得產品銷售的分成。
醫藥熱點
1.陳薇、施一公等當選中國科協副主席。中國科學技術協會第十次全國代表大會30日在京閉幕。中國科協九屆主席萬鋼連任中國科協第十屆全國委員會主席,軍事科學院軍事醫學研究院研究員陳薇院士、中國中醫科學院院長黃璐琦院士、西湖大學校長施一公等18人當選副主席。值得一提得是,5月29日,2020年度陳嘉庚科學獎舉行頒獎儀式,施一公以項目《剪接體的結構與分子機理研究》獲得生命科學獎,獎金100萬元人民幣。
2.北京取消350米藥店限距要求。北京市藥監局發布《北京市藥品監督管理局關于藥品零售經營許可審批改革有關工作的通知(征求意見稿)》,公開向社會征求意見。《征求意見稿》明確,取消新辦藥品零售企業應與已有的藥品零售企業之間350米以上可行進距離限制要求,對新申請的藥品零售企業,或原藥品零售企業申請變更注冊地址的,與已有藥店的距離不再作為許可審查條件。
3.《自然通訊》:人類壽命極限在120-150歲之間。頂級期刊《Nature Communications》雜志發表了一篇題為Longitudinal analysis of blood markers reveals progressive loss of resilience and predicts human lifespan limit的文章,研究人員對來自美國、英國和俄羅斯大量人群的健康數據進行動態評估后發現,人類的壽命極限在120-150歲之間。
審評動向
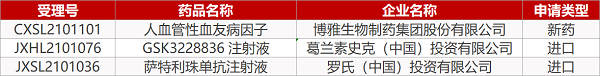
1. CDE新藥受理情況(06月02日)
申請臨床:
博雅生物的人血管性血友病因子、葛蘭素史克的GSK3228836 注射液、羅氏的薩特利珠單抗注射液。
申請生產:
2. FDA新藥獲批情況(北美06月01日)


來源:藥研發


