您當前的位置:檢測資訊 > 法規標準
嘉峪檢測網 2021-03-20 23:09
摘 要 / Abstract
兒童藥品是基本的民生保障,兒童用藥的安全問題則是各國面臨的共同挑戰。兒童藥品劑型和規格缺乏、專用藥少、用藥安全面臨風險等問題在我國長期存在。在加快兒童藥品上市的同時,需加強兒童藥品全生命周期的風險管理和控制,建立符合兒童特點的藥品風險管理體系和保險制度,確保兒童用藥安全。
Pediatric drugs provide essential guarantee for children’s welfare, while the safety of pediatric drugsis a common challenge faced by all countries. The lack of dosage forms and specifications for pediatric drugs,lack of pediatric-focused drugs and the safety risks posed by pediatric drug use are long-standing problemsin China. In addition to assuring faster access to pediatric drugs, it is necessary to enhance total life cycle riskmanagement and risk control of pediatric drugs and to establish a risk management system and insurancesystem best suited for children so as to ensure the safety of pediatric drug use.
關 鍵 詞 / Key words
兒童藥品;挑戰;風險管理;保險制度;用藥安全
pediatric drugs; challenge; risk management; insurance system; safety
2019年國家統計局統計數據顯示,我國0~14歲人口總數約為2.3億人,占總人口數的16%。每年的患病兒童數約占總患病人數的20%左右。根據《2019年我國衛生健康事業發展統計公報》,2019年我國出生人口為1465萬人。面對如此龐大的兒童人口基數,兒童藥品市場潛力巨大,加快建立和完善科學的風險管理體系是保證兒童用藥健康、規范、安全發展的重要措施。
01、兒童用藥風險管理特點
兒童用藥是指供兒童使用的藥品,將年齡作為兒童用藥的劃分依據是各國公認的做法。根據我國兒科學的定義以及國際慣例,將兒童明確為18周歲以下的特殊群體。兒童用藥界定為供18周歲以下特殊群體使用的藥品。
由于兒童具有特殊生理特點,處在生長發育階段,生理功能變化大,機體各器官系統功能尚未成熟,兒童用藥風險管理具有如下特點。
(一)長期性
由于藥物可能影響兒童生理以及認知能力的發育,一方面兒童受到損害后,其生理、心理影響持續的時間更長,后果更嚴重;另一方面對于兒童藥物的安全性需要開展長期研究,收集其對生長發育影響的數據,判定藥物對骨骼、行為、認知、性器官和免疫系統的成熟與發育的可能作用。
(二)復雜性
由于兒童的特殊生理特點,其發生藥害事件的可能性相比成人大大增加,損害發生的類型也更多樣。同時,由于兒童心理上的敏感性、不穩定性以及不成熟性,損害發生的原因也具有不可預測性。
(三)社會敏感性
兒童是每個家庭的希望,伴隨著社會的發展,對于兒童損害的社會關注度極高。由于兒童受試者在生理上的特殊性,藥害風險出現的幾率較大,甚至會造成兒童傷殘或者死亡,也可能引起家庭破裂以及醫患關系緊張,加劇社會矛盾。
02、兒童用藥風險管理現狀
兒童用藥的風險涉及研發、生產、流通和使用等多個環節,包括臨床試驗的相關風險、產品質量責任和不良反應發生的風險、運輸和存儲的風險、醫療執業和用藥救治的風險等。藥品上市許可持有人始終是風險管控的第一責任主體,生產企業、經營企業、醫療機構等則是不同環節的責任主體或負連帶責任,應與監管部門、媒體、學校、家長和個人等共同應對風險、處置風險和化解風險。
(一)兒童用藥風險管理流程
一般來說,藥品的風險管理分為4個階段:①風險識別。即對面臨的和潛在的風險進行判斷、歸類,鑒定風險性質。②風險評估。即在識別的基礎上,預判風險因素發生的可能性、嚴重程度及由此造成的影響。③風險控制。即根據風險評估結果,按照風險管理的目標,選擇最佳的風險控制手段,包括建立藥品追溯制度、藥品不良反應監測及藥物警戒制度、藥品召回制度等;針對損害,通過保險或自行協商方式進行賠償;暫停或終止臨床試驗、報告嚴重不良事件(serious adverse event,SAE),以及加強與媒體和公眾的風險交流等措施。④風險監控。即對現實風險進行監控,對風險管理手段適用性及收益性進行分析、修正和評估。
(二)兒童用藥風險管理規制現狀
堅持全過程風險管理理念是兒童藥和成人藥共同要遵守的準則。目前我國尚未出臺兒童用藥的專門法律法規,現有的藥品法規中也沒有針對兒童用藥風險管理的專門條款,只是歸在藥品大類中進行管理。兒童用藥的法律適用僅是一般性的規定,且整體法律層級不高。
1.法律法規對兒童知情權進行了單獨的規定
為保護兒童受試者權益與安全,《疫苗管理法》和《藥物臨床試驗質量管理規范》(Good Clinical Practice,GCP)對兒童受試者的知情權進行了規定。《疫苗管理法》第十八條規定,開展疫苗臨床試驗,應當取得受試者的書面知情同意;受試者為無民事行為能力人的,應當取得其監護人的書面知情同意;受試者為限制民事行為能力人的,應當取得本人及其監護人的書面知情同意。GCP第二十三條規定,兒童作為受試者,應當征得其監護人的知情同意并簽署知情同意書。當兒童有能力做出同意參加臨床試驗的決定時,還應當征得其本人同意,如果兒童受試者本人不同意參加臨床試驗或者中途決定退出臨床試驗時,即使監護人已經同意參加或者愿意繼續參加,也應當以兒童受試者本人的決定為準,除非在嚴重或者危及生命疾病的治療性臨床試驗中,研究者、監護人認為兒童受試者若不參加研究其生命會受到危害,這時其監護人的同意方可使患者繼續參與研究。在臨床試驗過程中,兒童受試者符合簽署知情同意的條件時,需要由本人簽署知情同意之后方可繼續實施。法律法規除對兒童知情權有特殊規定外,其他均未針對兒童有特殊要求。
2.明確“樣本量最小、標本最少、痛苦最小”是兒童臨床試驗的基本原則
2016年原國家食品藥品監督管理總局制定出臺了《兒科人群藥物臨床試驗技術指導原則》,強調“樣本量最小、標本最少、痛苦最小”是兒童臨床試驗的基本原則。指導原則雖然不具有強制性的法律約束力,但代表了藥品監管部門的觀點和認識,對于兒童用藥臨床試驗具有廣泛的引領作用。圍繞上述原則,近期又陸續出臺《成人用藥數據外推在兒科人群藥物臨床試驗及相關信息使用的技術指導原則》《真實世界研究支持兒童藥物研發與審評的技術指導原則(試行)》《兒科用藥臨床藥理學研究技術指導原則》等,伴隨技術指南的完善,我國兒童用藥臨床試驗的技術體系已經初見端倪。
3.對兒童受試者的保險和補償有原則性規定
《兒科人群藥物臨床試驗技術指導原則》中提及,鼓勵在兒科人群藥物臨床試驗中納入保險賠償機制。應在試驗方案中詳細寫明保險與補償方式,需要倫理委員會審核批準。試驗過程中發生意外醫療事件時,相關機構和研究者有義務對受試者提供緊急醫療救助。緊急醫療救助和隨后的醫學治療的范圍,以及由誰承擔費用,應在知情同意書中明確寫明。保險與補償方式是倫理審查的重點,這一點無論是兒童還是成人都是一致的。與成人的區別是進一步強調了緊急醫療救助,這也體現了對于兒童受試者一旦發生不良事件要第一時間救治,從而最大程度減少損害的基本原則。
(三)兒童用藥風險管理實踐中的問題
1.臨床試驗階段
與成人臨床試驗相比,兒童臨床試驗在倫理學考慮、入選操作和評價方法等諸多方面具有特殊性,并存在一定的困難。由于兒童臨床試驗存在多方面的阻礙因素,兒童用藥臨床試驗綜合成本高,企業開展兒童臨床試驗的動力不足。雖然近年來我國對兒童用藥采取了積極的審評策略,通過對“藥物臨床試驗機構備案管理信息平臺”登記的臨床試驗數據進行統計,兒童試驗每年只有30~40項左右,數量無顯著增長,僅占全部藥物臨床試驗數的2%左右。
(1)臨床試驗機構相對較少,多數機構風險管理經驗不足
在我國,兒童臨床試驗應在國家藥監局認可的兒科人群藥物臨床試驗機構進行;同時要求參與兒童藥物臨床試驗的研究者需要接受良好培訓,具有兒科研究經驗,具備判斷、處理和評價兒科不良事件的能力,特別是對緊急而嚴重的不良事件的處理能力。從兒童臨床試驗機構數量來看,根據國家藥監局資格認可公告統計,截至2019年10月31日,894家被公告的醫療機構中含兒科專業的醫療機構共158家,占比18%;其中兒童專科醫院及婦幼醫院共計32家,有資質的兒童藥物臨床試驗機構相對缺乏。雖然有資質的兒童臨床試驗機構超過100家,但從實際承接試驗來看,在“藥物臨床試驗登記與信息公示平臺”中登記的兒童臨床試驗只涉及49家臨床試驗機構,不少兒童臨床試驗機構尚無實際操作經驗。無論是從臨床試驗機構的數量,還是從臨床試驗機構的專業性來看,當前我國專業兒童臨床試驗機構并不充足,研究質量不高,也未形成系統性網絡。
(2)針對兒童受試者損害的保障不足
根據GCP要求,申辦者應當采取適當方式保證給予受試者和研究者補償或者賠償。申辦者應當向研究者和臨床試驗機構提供與臨床試驗相關的法律上、經濟上的保險或者保證;該保險或保證應與臨床試驗的風險性質和風險程度相適應。GCP對于損害賠償和補償只是進行了原則性的規定,但是對很多實踐中的具體問題均未有明確規定,包括:何為試驗相關的損害,臨床試驗適用過錯責任還是無過錯責任,是遵從現有法律對于人身損害的要求還是考慮到臨床試驗的特殊性有額外的規定,兒童受試者和成人受試者是否一樣等。
2.上市后階段
(1)兒童用藥品種較少
國內市場常用的3000多種處方藥中,兒童藥品所占比重不足5%。以北京兒童醫院為例,盡管在遴選藥品時盡可能優先選擇適宜兒童的品規,但兒童專用藥品僅有不足4%,其中處方藥更少,僅為2%,見表1。
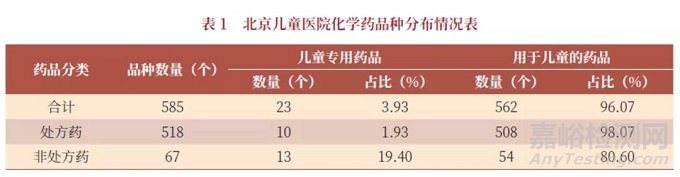
根據北京兒童醫院《兒童用藥現狀調查》課題調查顯示,15家醫院兒科用藥共同目錄1098種藥品中,兒童專用藥品極少,僅45種(4.10%)。此外,90%的藥品缺乏兒童適用劑型和規格,臨床上往往不得已采用成人藥品劑型或規格,酌情減量后給兒童使用。
(2)說明書兒童用藥信息不全
多數藥品說明書中未注明兒童用法用量,或僅標識“兒童酌減”或“兒童遵醫囑”,缺乏兒童療效和安全性數據。以北京兒童醫院為例,677個品規中,312種(46%)無兒童用法用量;365種(54%)有兒童用法用量,其中又有96種(26%)標明某些年齡段禁用、慎用或安全性不明確等。
(3)超說明書(off-label)用藥情況較多
在臨床實踐中,由于可供兒童使用的藥品品種、劑型及規格少、說明書信息不全等,現有兒童用藥不能滿足臨床用藥需求。在兒童用藥領域,超說明書用藥的情況比比皆是。超說明書用藥是指藥品使用的年齡、適應證、給藥方法、劑量及給藥途徑不在廠家提供的藥品說明書之內的用法。以北京兒童醫院為例,對10 716張門診處方審查的結果顯示,有53%的處方存在超說明書用藥的情況;通過對12987份住院醫囑審查的結果顯示,有27%的醫囑存在超說明書用藥的情況。
《兒科用藥處方審核規范的建立》課題組統計顯示,兒童超說明書用藥中,最主要的是超適應證用藥,約占50%,其次為超人群用藥,占30%,見圖1。盡管超說明書用藥存在其合理性,但潛在的法律風險不可忽視[1]。

(4)兒童藥品的不良反應不容忽視
《國家藥品不良反應監測年度報告(2019年)》顯示,2019年全國藥品不良反應監測網絡收到《藥品不良反應/事件報告表》151.4萬份,其中14歲以下兒童患者占10.2%,約為15.44萬份。2019年兒童藥品不良反應/事件報告中,注射劑占77.6%,口服制劑占16.4%。提示兒童作為特殊用藥人群,受臟器發育尚未完全等因素影響,對藥物更為敏感,耐受性較差,需重點關注其注射用藥風險。通過上市后不良反應的數據可以看出,兒童是高風險群體,其用藥的不良反應不容忽視,提高兒童用藥的安全性、減少兒童用藥不良反應發生的工作迫在眉睫。
03、加強兒童用藥風險管理的建議
通過學習研究和借鑒國外兒童用藥法規制度和風險管理的經驗[2-5],提出加強我國兒童用藥風險管理的幾點建議。
(一)針對兒童用藥單獨立法
目前,我國沒有專門針對兒童用藥的法律法規,關于兒童用藥的有關規定大多分散在多部藥品法規中,且缺乏系統監管。國家衛生健康委前期會同相關部門開展了一系列研討和論證工作,形成《兒童用藥保障條例(初稿)》,包括兒童用藥研發、生產、流通、使用、綜合評價等方面內容。伴隨著新修訂的《藥品管理法》、新出臺的《疫苗管理法》的實施,兒童用藥立法已經具備充分的可行性,建議參考《疫苗管理法》的立法形式,對兒童用藥單獨立法,在條例初稿的基礎上,廣泛征求社會各方意見,并加強與現行藥品管理法的銜接,加快推進立法工作。
(二)建立政產學研用金多方協作、緊密聯系的長效機制
兒童是國家的未來,兒童用藥的風險管理需要全社會的共同參與,各部門和單位之間的通力合作是實現兒童用藥安全有效的有力保障。要加強正面宣傳和科學引導,讓社會各界高度重視、高度理解兒童用藥風險發生的必然性以及不確定因素,傳播正能量和好聲音,塑造行業好形象,營造和諧醫患關系氛圍;要建立政產學研用金多方協作、緊密聯系的長效機制,調動藥品監管機構及其他政府相關部門、藥品研發機構、生產企業、醫療機構、學術界、金融界、教育界以及法律界等,圍繞兒童藥品風險管理的理論、路徑、實操等開展緊密合作,共同推動兒童藥品風險管理工作。
(三)形成符合兒童特點的以保險為重要手段的風險管理指引
為了使兒童得到全方位的安全保障,參考國際經驗,借鑒疫苗異常反應補償的相關方式,建議圍繞兒童藥品全生命周期(包括臨床、上市后等)制定分階段的以保險為重要手段的風險管理指引,并按照藥品、醫療器械、疫苗等予以區分,形成科學、可操作的“中國兒童用藥風險管理指引”。考慮到兒童風險管理特點,在現有的保險機制下,適當擴展保障范圍,涵蓋兒童用藥風險管理需要;簡化鑒定流程,體現人文關懷;同時為了保證兒童用藥損害后能夠快速、有效地得到賠償/補償,商業保險應采用零免賠、高保額的模式,兒童用藥發生的損害都在保險范圍內承擔,最大限度體現保險對維護兒童這一特殊群體權益的保障作用。此外,要積極探索建立政府、企業、福利組織和慈善機構等共同參與的藥物損害補償基金,開辟多種渠道和方式解決好兒童用藥風險管理問題。
(四)將“超說明書用藥”變成“說明書內用藥”
考慮到兒童用藥面臨的超說明書使用問題,建議圍繞超說明書用藥問題加強風險控制,建立合理的工作機制,將“超說明書用藥”盡快變成“說明書內用藥”。一方面鼓勵藥品生產企業針對兒童群體積極開展由研究者發起的上市后藥品臨床試驗;另一方面建立兒童藥品信息共享平臺,藥品生產企業可以第一時間獲得超說明書用藥信息,企業及時研究、評估,提出修訂說明書的注冊補充申請。
(五)完善相關配套措施
建議參考歐美國家的管理方式,對兒童臨床試驗進行風險分級,形成不同的倫理審查要點,匯總成我國《兒童臨床試驗倫理審查指南》,進一步明確兒童受試者的權利,以及研究者和申辦者的義務和法律責任;同時進一步細化藥品監管機構的權利和責任。

來源:中國食品藥品監管雜志


