您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-03-04 09:13
牽張成骨是治療復雜骨缺損的有效方法,新骨形成及鈣化不良是該技術臨床應用中亟待解決的問題。本研究將高純鎂棒作為髓內導向器用于大鼠股骨牽張成骨模型,結果表明隨著高純鎂棒的逐漸降解,鎂離子可以有效地促進新生骨鈣化。進一步RNA-seq和生信分析發現該過程可能是通過鎂離子調節Ptch蛋白激活Hedgehog-alternative Wnt復合信號通路來實現的。
01、研究內容簡介
骨缺損是由于創傷、感染、腫瘤、畸形等造成的常見結局,臨床治療非常困難。牽張成骨技術自上世紀60年代應用于骨科臨床,取得了良好的臨床效果。牽張成骨技術通過給活體組織持續、穩定的緩慢牽伸力,刺激或激活組織細胞的再生和活躍生長, 其生長方式類似胎兒組織。牽張成骨技術目前應用越來越廣泛,但一個共性問題是新骨形成鈣化緩慢、薄弱,以至于帶支架時間長,再骨折、感染、關節僵硬等并發癥增多。這些都導致治療周期延長,給患者的生活工作帶來了極大的不便,增加了經濟和精神負擔,限制了牽張成骨技術的臨床應用。因此,在牽張成骨過程中提高新骨形成和鈣化的速度,縮短帶架時間是臨床亟待解決的問題。
醫用可降解鎂金屬的成骨作用和機制研究是近年來的研究熱點。既往研究發現各種形式的鎂金屬在體內外均有良好的成骨作用。鎂有良好的成骨效果,那么能否利用鎂來促進牽張成骨新骨形成鈣化呢?由于牽張成骨是一種特殊狀態下的新骨形成和鈣化,鎂能否應用于牽張成骨中,對于這種特殊狀態的新骨形成鈣化是否有促進作用、其機制如何,之前國內外仍是研究空白。課題組在近期研究中發現高純鎂棒可以通過VHL /HIF-1α/ VEGF信號通路促進牽張成骨中新生血管生成達到促進新生骨鈣化過程。
盡管在先前的研究中我們發現了高純鎂棒通過激活VHL /HIF-1α/ VEGF信號通路增強了牽張成骨新生骨鈣化,但其機制研究局限于血管生成,上游的機制仍不清楚。針對這一問題,課題組在之前的研究的基礎上進行了鎂對于牽張成骨作用及機制的一系列研究。在本研究中課題組將高純鎂棒作為髓內導向器用于大鼠股骨牽張成骨模型,用不銹鋼組和空白組作為對照(Fig.1)。

Fig.1. a: The grouping of rat femur DO model. b: Timeline for distraction protocol.
我們對術后第3、6、9周組織進行X線片、micro-CT檢測觀察,發現高純鎂組顯著加快成骨鈣化速度(Fig.2)。
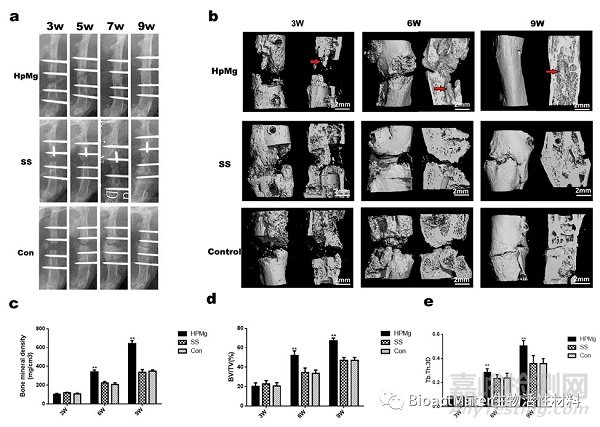
Fig.2. Hp Mg accelerated bone consolidation during distraction osteogenesis in rats. a:X-ray images of the distraction regenerate at 3,5,7 and 9 weeks after distraction. b: Representative 3D micro-CT images of the distraction zone after surgery 3,6 and 9 weeks. c, d, e: Quantitative analysis of micro-CT data showed higher values of BMD, BV/TV and Tb.Th in the Hp Mg group at consolidation phase (**p < 0.01).
相應的組織學觀察也顯示在術后第9周高純鎂組已基本完成鈣化過程,明顯優于不銹鋼組和空白組(Fig3f,g)。力學檢測進一步顯示出高純鎂組有更好的力學性能(Fig3d,e)。這些結果都表明,在牽張的同時,隨著高純鎂棒的逐漸降解,可以有效地促進新生骨成骨鈣化。

Fig.3. a: In vivo 3D micro-CT images of the Hp Mg and SS pins. b: Volume change of intramedullary Hp Mg pins. c: Bone volume surrounding Hp Mg and SS pins (**p < 0.01). d, e: Mechanical tests (ultimate load and energy to failure) of the distracted femur. The values were normalized to the corresponding contralateral normal femur (**p < 0.01). f:H&E staining Hp Mg group enhanced bone consolidation in comparison with the SS and control group. g: In Saffron solid green, at 6 and 9weeks chondrocytes cartilage were evident in the SS and control groups compared to the Hp Mg group.
鎂對于牽張新生骨的形成鈣化的促進機制是什么?是否與前期研究的VHL /HIF-1α/ VEGF信號通路有關呢?為此,課題組于鈣化中期取新生骨組織進行高通量轉錄組測序(RNA-seq),與不銹鋼組和空白組比較得到差異表達基因,并對差異表達基因進行了KEGG通路富集分析。KEGG通路富集結果顯示,Wnt通路在所有通路中排名第二并且在成骨相關通路中富集最明顯。VHL /HIF-1α/ VEGF信號通路雖然也有富集,但排名比較靠后(Fig.4)。該研究結果首次揭示了鎂促進牽張成骨的主要信號通路與Wnt通路相關。

Fig.4. a: Summary of DEGs. Red color represents up-regulated DEGs. Blue color represents down-regulated DEGs. b, c, d: Volcano plot. Red points represent up-regulated DEGs. Blue points represent down-regulated DEGs. Gray points represent non-DEGs. e: Venn diagram of DEGs. f: Bubble chart showing top 20 enriched pathways in the KEGG.
進一步對于Wnt通路關鍵基因研究中,課題組發現經典Wnt 通路的Wnt 分子及其下游的β-catenin未差異表達,而近期研究發現的Alternative Wnt信號通路完全被激活。2015年Park HW等在Cell上發表的研究顯示:Alternative Wnt信號通路通過Wnt5b蛋白刺激膜蛋白Fzd,進一步激活YAP/TAZ并入核促進核內TEAD高表達,從而促進Runx2等成骨基因表達而促進成骨。我們針對Wnt通路關鍵基因進行了qPCR、WesternBlot和免疫組化驗證。結果驗證高純鎂通過Alternative Wnt通路,而不是經典Wnt通路,促進牽張成骨鈣化。
Wnt5b作為激活Alternative Wnt通路的上游配體,在骨生長及骨折愈合過程中有重要作用,尤其在軟骨內成骨中有重要作用。我們前期研究也發現Wnt5b有高表達。因此,針對Wnt5b我們通過生物信息學進一步探索上游基因并與前期RNA-Seq結果比對,發現其上游基因中Gli1和Gli2有高表達(Fig.5a)。Gli1和Gli2都是Hedgehog通路的關鍵核轉錄因子。Hedgehog信號通路是一條保守且重要的信號通路,參與體內多種生物代謝過程中。研究顯示Hedgehog信號通路參與骨形成,代謝以及骨折愈合等代謝過程,抑制Hedgehog通路會導致骨折不愈合或延遲愈合。當存在Hedgehog蛋白時,Hedgehog蛋白與Patched(Ptch)受體結合,阻斷Ptch對Smoothed(Smo)受體的抑制,促使Smo受體發生磷酸化修飾,活化的Smo受體抑制PKA的活性,從而抑制了對Gli蛋白的裂解,使核轉錄因子Gli家族蛋白完整的在核內發揮作用促進成骨鈣化基因表達,其中Gli1 和Gli2在蛋白水平作用相似, 均可以促進Wnt5b表達(Fig.5b)。因此,我們針對Hedgehog通路關鍵基因進行了qPCR、WesternBlot和免疫組化驗證。結果驗證高純鎂通過Hedgehog-Alternative Wnt通路促進牽張成骨鈣化。

Fig.5.a: Wnt5b gene radar analysis. b: RNA-seq results enrichment map of Hedgehog pathway.
針對這些Hedgehog通路上游基因我們比對了RNA Seq結果并做了進一步的qPCR及Western Blot驗證。結果發現膜表面受體Smo,Ptch均有高表達,而三種Hedgehog蛋白基因均未高表達(Fig.5b)。關于膜蛋白Ptch的研究中,Hitzenberger M等通過分子動力學實驗發現,Ca2+、Zn2+作為二價金屬離子在Hedgehog蛋白調控Ptch過程中發揮了重要作用。因此可以假設同樣作為二價金屬離子的鎂離子通過某種機制取代Hedgehog蛋白的二價金屬離子結構與Ptch結合,改變其蛋白構象和功能,減少對Smo的抑制,進一步激活Hedgehog通路。因此,我們以鈉離子作為對照通過分子動力學模擬鎂離子對Ptch蛋白構象變化。結果顯示結果表明,Mg2 +與Ptch蛋白表面的酸性氨基酸殘基Glu592,Asp803和Asp804形成配位鍵,從而穩定了562-595和794-803區的結構。鎂離子與其他酸性殘基Glu191,Glu188,Glu205,Asp782,Asp361,Asp105和Asp787形成配位鍵,這在穩定Ptch蛋白結構中也起著重要作用(Fig.6a)。
至此,結合全部前期試驗結果,我們提出鎂促進牽張成骨新生骨的成骨鈣化作用的機制假說。其可能的機制是:鎂通過調控膜受體Ptch,減少對膜受體Smo的抑制作用,進而激活Hedgehog通路,而該通路的Gli1和Gli2轉錄表達Wnt5b激活Alternative Wnt通路,通過YAP/TAZ蛋白轉錄生成Runx2等成骨相關蛋白表達,從而促進牽張成骨中新生骨的成骨鈣化(Fig.6b)。通過上述實驗,我們明確鎂在牽張成骨過程中促進成骨鈣化的具體調控機制,為醫用可降解鎂金屬髓內導向這一創新方法克服臨床上牽張成骨關鍵難點提供理論依據。

Fig.6. a: Molecular dynamics simulation results. Mg2+ forms a coordination bond with Glu592, Asp803, Asp804, Glu191, Glu188, Glu205, Asp782, Asp361, Asp105, and Asp787. b: Schematic diagram showing diffusion of implant-derived Mg2+ enhances bone consolidation in distraction osteogenesis via regulating Ptch protein activating Hedgehog-alternative Wnt signaling.
02、通訊作者簡介
第一作者:木沙·哈木山
上海交通大學附屬第六人民醫院,骨科,2020級博士研究生,研究方向為鎂基材料在骨科應用以及骨關節感染免疫機制。
通訊作者:韓培
上海交通大學附屬第六人民醫院,骨科,主任醫師,博士,碩導。長期從事創傷骨科與修復重建外科的臨床工作,作為組長負責骨關節與軟組織感染專業組臨床工作,作為Co-PI共同負責骨研所骨內植物感染實驗平臺科研工作。主要研究方向生物醫用鎂金屬材料的醫工交叉研究,骨關節感染的臨床基礎研究。主持國家、省部級課題5項,先后以第一作者/共同第一作者/通訊作者在Biomaterials、Acta Biomaterialia等雜志發表SCI論文近20篇。研究獲得上海市科技進步一等獎和華夏醫學科技進步一等獎。
沈灝
上海交通大學附屬第六人民醫院,骨科,主任醫師,博士,博導,上海交通大學附屬第六人民醫院骨科副主任,上海市四肢顯微研究所骨關節內植物感染實驗平臺負責人。長期從事關節外科的臨床和研究工作。主要從事關節置換和骨科感染的臨床和基礎研究,骨科內植物感染的發病機制和抗菌生物材料的研發和轉化研究。主持國家級及省部級課題5項,完成2次成果鑒定,多次獲得國家級及省部級醫學科技獎勵。先后以第一作者/共同第一作者/通訊作者在ACS Nano、Acta Biomaterialia、The Journal of infection等雜志發表SCI論文近50余篇,主編和參編專著8部。
張小農
上海交通大學材料科學與工程學院博士生導師,主持和參加國家重點研發專項、國家“863”高技術計劃、國家自然科學基金、上海市納米專項基金等科研項目30余項,發表學術論文150多篇(其中2篇論文入選ESI高被引論文),參編著作3部,授權發明專利20多項,獲得國家自然科學二等獎 、上海市科技進步一等獎和二等獎各一次。
03、資助信息
該研究得到了國家自然科學基金(81974325,81702183)和上海市科委基金(18ZR1428700, 19441903000)等項目的支持。
04、原文信息
Musha Hamushan #, Weijie Cai , Yubo Zhang, Zun Ren, Jiafei Du, Shaoxiang Zhang, Changli Zhao, Pengfei Cheng, Xiaonong Zhang*, Hao Shen*, Pei Han *
High-purity magnesium pin enhances bone consolidation in distraction osteogenesis via regulating Ptch protein activating Hedgehog-alternative Wnt signaling.
Bioactive Materials 2020;6(6):1563-1574

來源:BioactMater生物活性材料


