您當(dāng)前的位置:檢測(cè)資訊 > 行業(yè)研究
嘉峪檢測(cè)網(wǎng) 2024-07-18 09:16
摘要
罕見病是全人類面臨的重大醫(yī)學(xué)挑戰(zhàn)。目前全球范圍內(nèi)已知的罕見病有7000~10000 種,中國(guó)罕見病患者數(shù)量眾多,大多數(shù)患者面臨著無(wú)藥可治或者境外有藥、境內(nèi)無(wú)藥的問題。藥品審評(píng)審批制度改革以來(lái),我國(guó)從政策文件、法律規(guī)范、技術(shù)標(biāo)準(zhǔn)等維度規(guī)范了罕見病范圍、罕見病藥品加快審評(píng)途徑、技術(shù)標(biāo)準(zhǔn)等內(nèi)容,加快罕見病藥品上市,以求不斷滿足罕見病患者用藥需求。通過(guò)對(duì)我國(guó)罕見病藥品審評(píng)審批制度的分析,建議從罕見病藥品認(rèn)定標(biāo)準(zhǔn)、設(shè)立專門機(jī)構(gòu)、建立市場(chǎng)獨(dú)占期制度、加大研發(fā)指導(dǎo)等方面完善罕見病藥品審評(píng)審批制度。
【關(guān)鍵詞】 罕見病;罕見病藥品;審評(píng)審批制度改革
罕見病是全人類面臨的重大醫(yī)學(xué)挑戰(zhàn)。罕見病患病率、發(fā)病率在總?cè)丝谥姓急葮O低,但嚴(yán)重威脅著患者的生命和健康。我國(guó)罕見病患者數(shù)量眾多,大多數(shù)患者面臨著無(wú)藥可治或境外有藥、境內(nèi)無(wú)藥的問題。世界范圍內(nèi),罕見病藥品也存在研發(fā)成本高昂、市場(chǎng)空間狹小、投資回報(bào)率低且風(fēng)險(xiǎn)高的困境,企業(yè)研發(fā)動(dòng)力不足。黨的二十大報(bào)告指出,必須堅(jiān)持在發(fā)展中保障和改善民生,推進(jìn)健康中國(guó)建設(shè),把保障人民健康放在優(yōu)先發(fā)展的戰(zhàn)略位置。在我國(guó)罕見病總體人群數(shù)量龐大、疾病負(fù)擔(dān)重,該類患者人群面臨的困境正越來(lái)越引起政府和社會(huì)的廣泛關(guān)注。藥品審評(píng)審批制度改革以來(lái),我國(guó)逐步構(gòu)建起以臨床價(jià)值為導(dǎo)向的科學(xué)審評(píng)體系,通過(guò)多種藥品加快上市注冊(cè)程序,加快罕見病藥品上市,不斷滿足罕見病患者用藥需求。
一、罕見病及罕見病藥品
罕見病是一種患病率和發(fā)病率極低的疾病,由于經(jīng)濟(jì)發(fā)展不同和種族差異等因素,各國(guó)對(duì)罕見病定義有微小差別,但是有相對(duì)共同、經(jīng)典的核心病種。世界目前全球范圍內(nèi)已知的罕見病有7000~10000種,其中公認(rèn)的約7000 多種,占人類已知疾病的10% ,涉及患者數(shù)約 3.5 億例[1]。據(jù)2020 年一項(xiàng)流行病學(xué)調(diào)查研究顯示,14歲及以下死亡的兒童中約56.8%患有罕見病,是兒童死亡的主要原因。約80%的罕見病為遺傳性疾病,多數(shù)在生命早期即可發(fā)病。有數(shù)據(jù)顯示,約35%的罕見病患兒在出生后1 年內(nèi)死亡。
1.1 境外罕見病定義
由于世界各國(guó)和地區(qū)經(jīng)濟(jì)發(fā)展、醫(yī)療水平、社會(huì)保障程度差異較大,目前對(duì)于罕見病未有統(tǒng)一的標(biāo)準(zhǔn)。世界衛(wèi)生組織( Wond Health Organization,WHO)將罕見病定義為發(fā)病率在 0.65%~1%的疾病。美國(guó)是世界上最早提出罕見病并從法律層面進(jìn)行界定的國(guó)家,其主要基于患者數(shù)對(duì)罕見病進(jìn)行定義,在1983 年出臺(tái)的《孤兒藥法案》(0rphan Drug Act,ODA)中將“美國(guó)患病人數(shù)少于 20 萬(wàn)的疾病”定義為罕見病,2003 年發(fā)布的《罕見病法案》( Rare Dis.eases Act,RDA)對(duì)罕見病定義進(jìn)行了擴(kuò)展:“患病人數(shù)少于 20 萬(wàn)的疾病,或者患病人數(shù)超過(guò) 20 萬(wàn)但預(yù)期其治療藥品銷售額難以收回研發(fā)成本的疾病”。據(jù)此,美國(guó) FDA 在 2013 年發(fā)布的“0rphanDrug Regulations”中,明確孤兒藥是指在美國(guó)影響人Drug Regulations”中,明確孤兒藥是指在美國(guó)影響人數(shù)少于 20 萬(wàn)例,或影響人數(shù)多于 20 萬(wàn)例且沒有合理預(yù)期表明在美國(guó)的銷售收人大于研發(fā)成本的所有疾病的藥品。澳大利亞也采用患病人數(shù)標(biāo)準(zhǔn)定義罕見病(患者少于2000 例的疾病)。歐盟主要以患病率為標(biāo)準(zhǔn)進(jìn)行定義,規(guī)定患病率低于 0.5%、危及生命或嚴(yán)重慢性衰退性疾病,其針對(duì)性治療藥品的銷售額難以收回研發(fā)成本的疾病,或目前該疾病沒有令人滿意的治療藥品的疾病為罕見病。俄羅斯、新西蘭、巴西等國(guó)家也采用此定義標(biāo)準(zhǔn)。還有一些國(guó)家和地區(qū)采用患病人數(shù)和患病率相結(jié)合的標(biāo)準(zhǔn),如日本規(guī)定,患病人數(shù)少于5 萬(wàn)或患病率低于 1/2500的疾病,且目前無(wú)合適的用于預(yù)防和診療藥品的疾病為罕見病。韓國(guó)亦采用此種定義標(biāo)準(zhǔn)。不難看出,各個(gè)國(guó)家和地區(qū)在定義罕見病中主要包含患病率、患者總?cè)丝凇⒓膊∥V匕Y3個(gè)因素,有的采用1個(gè)標(biāo)準(zhǔn),有的采用多個(gè)標(biāo)準(zhǔn)。但在定義罕見病用藥時(shí),均將經(jīng)濟(jì)因素,即藥品銷售收人與研發(fā)投人成本之間的關(guān)系納人考量范圍。
1.2 我國(guó)罕見病定義
自 1984年“罕見病”概念在我國(guó)出現(xiàn)至今,目前在法律法規(guī)等規(guī)范性文件中,尚未對(duì)罕見病進(jìn)行明確界定。2010年,中華醫(yī)學(xué)會(huì)醫(yī)學(xué)遺傳學(xué)分會(huì)提出將罕見病定義為“患病率<1/500 000 或新生兒發(fā)病率<1/10 000 的疾病”。《中國(guó)罕見病定義研究報(bào)告 2021》指出,新生兒發(fā)病率<1/10 000、患病率<1/10 000、患者數(shù)<14 萬(wàn)的疾病被定義為罕見病。目前對(duì)罕見病界定的文件是2018年5月11日國(guó)家衛(wèi)生健康委員會(huì)等五部委聯(lián)合發(fā)布的《第一批罕見病目錄》[2],通過(guò)目錄的方式列舉了 121 種罕見病。國(guó)家衛(wèi)生健康委員會(huì)等機(jī)構(gòu)此前公布的數(shù)據(jù)顯示我國(guó)現(xiàn)有各類罕見病患者2000多萬(wàn)例,每年新增患者超過(guò) 20 萬(wàn)例,95%的患者缺少特效藥治療[3]。2023 年9月18 日國(guó)家衛(wèi)生健康委員會(huì)等6個(gè)部門聯(lián)合制定了《第二批罕見病目錄》列舉了89 種罕見病。目前2批目錄通過(guò)列舉的方式,劃定了207種罕見病范圍。罕見病定義的不斷清晰,有利于我國(guó)罕見病的診療和保障走向規(guī)范化、制度化和法制化。2018年,國(guó)家衛(wèi)生健康委員會(huì)發(fā)布《罕見病目錄制訂工作程序》,指出將分批遴選目錄覆蓋病種對(duì)目錄進(jìn)行動(dòng)態(tài)更新;更新時(shí)間原則上不短于2年。納人目錄的病種應(yīng)同時(shí)滿足以下條件:① 國(guó)內(nèi)外有證據(jù)表明發(fā)病率或患病率較低。②對(duì)患者和家庭危害較大。③ 有明確診斷方法。④ 有治療或干預(yù)手段、經(jīng)濟(jì)可負(fù)擔(dān),或尚無(wú)有效治療或干預(yù)手段但已納人國(guó)家科研專項(xiàng)。
1.3 罕見病藥品
用于預(yù)防、診斷、治療罕見病的藥物統(tǒng)稱“罕見病藥品”。世界上最早從法律層面界定罕見病的是美國(guó),1983 年出臺(tái)《孤兒藥法案》,同時(shí)罕見病藥品研發(fā)成本高昂、市場(chǎng)需求小、投資回報(bào)低,企業(yè)生產(chǎn)研發(fā)意愿不高,罕見病患者可用藥品極其缺少,因此罕見病藥品又被稱為“孤兒藥”(orphan drug)。在我國(guó)““孤兒藥”最早出現(xiàn)在 1990年孫國(guó)鳳等的《大阪大學(xué)克隆分泌胃酸的質(zhì)子泵以探索抗?jié)儎┑淖饔谩分校诜g時(shí)將“orphan drug”翻譯為“孤兒藥”。此后“孤兒藥”在我國(guó)學(xué)界得到使用。目前我國(guó)的法律法規(guī)和規(guī)范性文件中一般使用“罕見病藥品”或“罕見病用藥”的表述[4]。
二、美國(guó)、歐盟罕見病藥品審批情況
2.1 美國(guó) FDA
美國(guó)是世界上首個(gè)針對(duì)罕見病藥品進(jìn)行立法的國(guó)家。1983 年,美國(guó)頒布了《孤兒藥法案》,從立法層面對(duì)罕見病藥品的鼓勵(lì)研發(fā)、加快審評(píng)及稅費(fèi)減免等激勵(lì)政策予以規(guī)定。此后該法案進(jìn)行了4次重大修改,分別于 1985 年修訂了孤兒藥市場(chǎng)獨(dú)占期條款,1997 年增加孤兒藥審評(píng)費(fèi)用條款,2007 年增加豁免孤兒藥處方藥或生物制品批準(zhǔn)或許可的產(chǎn)品費(fèi)及場(chǎng)地費(fèi)條款,2017 年修訂臨床試驗(yàn)稅收抵免條款[5]。美國(guó) FDA 成立了專門機(jī)構(gòu)——孤兒藥研發(fā)辦公室(Office of 0rphan Products Development,00DP)負(fù)責(zé)制定與修訂孤兒藥政策、實(shí)施孤兒藥各項(xiàng)條例并負(fù)責(zé)孤兒藥資格的認(rèn)定。
美國(guó)未對(duì)孤兒藥設(shè)立專門的加快審批程序。但因孤兒藥的特殊身份和其臨床價(jià)值,可適用美國(guó)FDA 優(yōu)先審評(píng)、加速審評(píng)、快速通道、突破性治療等加快程序。通過(guò)加快上市程序,最快的孤兒藥審評(píng)審批用時(shí)縮短為6個(gè)月。孤兒藥法案實(shí)施以來(lái),罕見病藥品研發(fā)上市數(shù)量顯著增加。截至 2020年3月底美國(guó) FDA 共授權(quán) 5 320 件罕見病藥品資格認(rèn)定,涉及2 949 種罕見病,已有 458 個(gè)罕見病藥品獲批上市[6]。
2.2 歐洲EMA
歐盟(European Commission,EC)于 1999 年頒布《孤兒藥管理法規(guī)》為歐盟各國(guó)孤兒藥法規(guī)的制定奠定了法律基礎(chǔ)。歐洲EMA 負(fù)責(zé)統(tǒng)一管理歐盟范圍內(nèi)醫(yī)療產(chǎn)品有關(guān)事宜,并成立專門的孤兒藥品委員會(huì)(Committee for Orphan Medical Products,COMP)負(fù)責(zé)罕見病藥品孤兒藥身份的認(rèn)定。
獲得孤兒藥身份的藥品由歐盟人用藥品委員會(huì)(Committee for Medical Products for Human Use.CHMP)提出審評(píng)意見,可適用加速審批、有條件審批、特殊審批及優(yōu)先審批等加速審批路徑,并最終由EC 作出審批決定。通過(guò)審評(píng)的孤兒藥可在成員國(guó)內(nèi)流通與銷售,無(wú)需再向成員國(guó)提交單獨(dú)的上市申請(qǐng)。
歐盟孤兒藥身份管理制度類似于美國(guó),一方面成立了專門機(jī)構(gòu)負(fù)責(zé)孤兒藥的資格認(rèn)定,另一方面資格認(rèn)定是使用制度的前提,只有通過(guò)認(rèn)定后,才可享有一系列針對(duì)孤兒藥研發(fā)的激勵(lì)政策,如免除監(jiān)管費(fèi)用、提供研發(fā)資助、提供協(xié)議援助、10 年市場(chǎng)獨(dú)占期等。同時(shí),由于罕見病自身特點(diǎn)和孤兒藥研發(fā)的難度,歐盟內(nèi)部成員國(guó)之間以及歐盟與其他國(guó)家監(jiān)管機(jī)構(gòu)開展臨床試驗(yàn)合作和數(shù)據(jù)共享。
三、我國(guó)罕見病藥品審評(píng)審批情況
3.1 制度體系
2015 年審評(píng)審批改革啟動(dòng)之后,我國(guó)藥品監(jiān)管部門持續(xù)深化改革,落實(shí)改革要求,逐步構(gòu)建以臨床價(jià)值為導(dǎo)向的審評(píng)審批體系,形成了政策、法律、規(guī)章、技術(shù)標(biāo)準(zhǔn)等多層次的制度規(guī)范,從罕見病認(rèn)定標(biāo)準(zhǔn)、罕見病研發(fā)技術(shù)指導(dǎo)、罕見病藥品加快上市程序、罕見病藥品醫(yī)療保障、罕見病藥物研發(fā)生產(chǎn)稅收減免等多個(gè)維度予以規(guī)定,為企業(yè)投入罕見病藥品的研發(fā)生產(chǎn)提供了動(dòng)力,為罕見病藥品加快上市提供了路徑,為罕見病患者有藥可用提供了保障,從規(guī)范層級(jí)來(lái)看,形成了國(guó)務(wù)院、中共中央辦公廳、國(guó)務(wù)院辦公廳發(fā)布的政策文件,全國(guó)人大常委會(huì)制定的法律,國(guó)家藥品監(jiān)督管理局等制定的部門規(guī)章,國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心(以下簡(jiǎn)稱“藥審中心”)等技術(shù)部門制定的技術(shù)標(biāo)準(zhǔn)等多層次、多維度的規(guī)范性文件體系。從規(guī)范內(nèi)容來(lái)看,從鼓勵(lì)研發(fā)、加快審評(píng)、醫(yī)保保障、稅收減免等方面,對(duì)于罕見病的范圍、罕見病藥品研發(fā)的技術(shù)標(biāo)準(zhǔn)、罕見病藥品的認(rèn)定、加快審評(píng)程序、上市后的市場(chǎng)獨(dú)占期、增值稅技術(shù)稅率等方面對(duì)罕見病藥品的研發(fā)、審評(píng)、使用、銷售等環(huán)節(jié)予以細(xì)化明確。針對(duì)絕大多數(shù)罕見病為遺傳疾病、多在兒童生長(zhǎng)發(fā)育關(guān)鍵期發(fā)病的特點(diǎn),藥審中心完善審評(píng)標(biāo)準(zhǔn)體系,加強(qiáng)溝通與交流,發(fā)布多項(xiàng)罕見病用藥、兒童用藥等技術(shù)指導(dǎo)原則。同時(shí),為避免重復(fù)開展臨床試驗(yàn)、降低研發(fā)成本、促進(jìn)境內(nèi)外企業(yè)合作,藥審中心還發(fā)布了多項(xiàng)境外已上市、境內(nèi)未上市藥品藥學(xué)、臨床試驗(yàn)等相關(guān)指導(dǎo)原則。
不難看出,經(jīng)過(guò)近年來(lái)的努力,罕見病藥品的相關(guān)制度建立逐漸完善,對(duì)于企業(yè)的鼓勵(lì)力度也不斷加大。
3.2 審評(píng)審批流程
依據(jù) 2020年1月頒布實(shí)施的《藥品注冊(cè)管理辦法》,我國(guó)設(shè)立突破性治療藥物程序、附條件批準(zhǔn)程序、優(yōu)先審評(píng)審批程序、特別審批程序 4 條藥品加快上市注冊(cè)程序。與美國(guó) FDA、歐洲 EMA 等相同,我國(guó)雖未對(duì)罕見病藥品單獨(dú)設(shè)立快速審評(píng)通道,但可將其納入優(yōu)先審評(píng)等加快程序[7],近年來(lái)罕見病藥品上市速度顯著加快[8-9]。以下從優(yōu)先審評(píng)審批程序梳理罕見病藥品的審批流程。
3.2.1 納入優(yōu)先審評(píng)的罕見病藥品范圍
臨床亟須的短缺藥品、防治重大傳染病和罕見病等疾病的創(chuàng)新藥和改良型新藥,或列人國(guó)家藥品監(jiān)督管理局《臨床急需境外新藥名單》臨床亟須的境外已上市境內(nèi)未上市的罕見病藥品,需具有明顯臨床價(jià)值。
3.2.2 審評(píng)審批流程
① 申請(qǐng)人在提出藥品上市許可申請(qǐng)前,應(yīng)當(dāng)與藥審中心進(jìn)行溝通交流,探討現(xiàn)有研究數(shù)據(jù)是否滿足藥品上市許可審查要求以及是否符合優(yōu)先審評(píng)審批程序納入條件等。②對(duì)于初步評(píng)估認(rèn)為符合優(yōu)先審評(píng)審批納人條件的,經(jīng)溝通交流確認(rèn)后,申請(qǐng)人在提出藥品上市許可申請(qǐng)的同時(shí),一并提出優(yōu)先審評(píng)審批申請(qǐng),并提交相關(guān)支持性資料。③ 藥審中心應(yīng)當(dāng)在接到申請(qǐng)后5d內(nèi)對(duì)提交的優(yōu)先審評(píng)審批申請(qǐng)進(jìn)行審核,并將審核結(jié)果反饋給申請(qǐng)人。④ 藥審中心對(duì)擬納入優(yōu)先審評(píng)審批程序的品種具體信息和理由予以公示,包括藥物名稱,申請(qǐng)人、擬定適應(yīng)證(或功能主治)、申請(qǐng)日期、擬納人理由等。公示5d內(nèi)無(wú)異議的,正式納人優(yōu)先審評(píng)審批程序,并通知各相關(guān)方。公示期內(nèi)提出異議的,異議方在5d內(nèi)向藥審中心提交書面意見并說(shuō)明理由:藥審中心在10d內(nèi)另行組織論證后作出決定并通知各相關(guān)方。⑤ 藥審中心對(duì)納人優(yōu)先審評(píng)審批程序的藥品上市許可申請(qǐng),按注冊(cè)申請(qǐng)受理時(shí)間順序優(yōu)先配置資源進(jìn)行審評(píng)。對(duì)納人優(yōu)先審評(píng)審批程序的藥品上市許可申請(qǐng),審評(píng)時(shí)限為 130 d,其中臨床急需的境外已上市、境內(nèi)未上市的罕見病藥品審評(píng)時(shí)限為 70 d。⑥ 對(duì)納人優(yōu)先審評(píng)審批程序的藥品上市許可申請(qǐng),需要進(jìn)行核查、檢驗(yàn)和核準(zhǔn)通用名稱的,藥品核查中心、藥品檢驗(yàn)機(jī)構(gòu)和國(guó)家藥典委員會(huì)應(yīng)優(yōu)先進(jìn)行核查、檢驗(yàn)和核準(zhǔn)通用名稱。⑦藥審中心在收到核查結(jié)果、檢驗(yàn)結(jié)果等相關(guān)材料后在審評(píng)時(shí)限內(nèi)完成綜合審評(píng)。⑧行政審批決定應(yīng)當(dāng)在 10 d內(nèi)作出。
審評(píng)過(guò)程中發(fā)現(xiàn)需要與申請(qǐng)人進(jìn)行溝通交流的,藥審中心可根據(jù)具體情況優(yōu)先安排。
罕見病藥品也可適用突破性治療藥物程序、附條件批準(zhǔn)程序加快審批。如果在藥物臨床試驗(yàn)期間,用于防治嚴(yán)重危及生命或者嚴(yán)重影響生存質(zhì)量的疾病,且尚無(wú)有效防治手段或者與現(xiàn)有治療手段相比有足夠證據(jù)表明具有明顯臨床優(yōu)勢(shì)的創(chuàng)新藥或者改良型新藥等,可以申請(qǐng)適用突破性治療藥物程序。治療嚴(yán)重危及生命且尚無(wú)有效治療手段疾病的藥品,藥物臨床試驗(yàn)已有數(shù)據(jù)證實(shí)療效并能預(yù)測(cè)其臨床價(jià)值的,可以申請(qǐng)附條件批準(zhǔn)。多重加快審評(píng)程序的綜合應(yīng)用,極大地加快了罕見病藥品的上市速度。
3.3 批準(zhǔn)情況
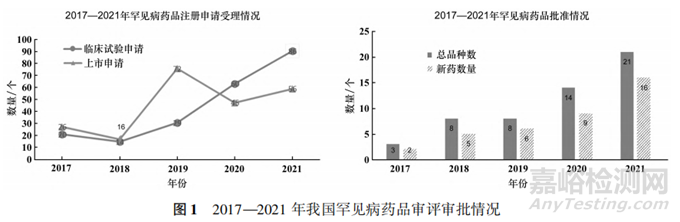
近年來(lái),隨著藥品審評(píng)審批制度的建立健全、審評(píng)能力和審評(píng)體系現(xiàn)代化建設(shè)水平的不斷提升,藥審中心緊密圍繞以患者為中心的監(jiān)管理念,推進(jìn)臨床急需藥物進(jìn)一步加速上市惠及患者。在罕見病藥品審評(píng)方面,藥審中心通過(guò)“快速通道”和臨床急需境外新藥審評(píng)審批工作程序?yàn)楹币姴∷幤烽_辟“綠色通道”,合理配置審評(píng)資源,實(shí)現(xiàn)藥品“急用先行”。通過(guò)這些加快措施,2022年獲批的進(jìn)口罕見病藥品絕大多數(shù)豁免境內(nèi)臨床試驗(yàn),境內(nèi)外上市時(shí)間差約為3年。2019-2022 年共有64個(gè)罕見病品種通過(guò)優(yōu)先審評(píng)獲批上市,2022 年 22 個(gè)罕見病藥品中,進(jìn)口藥 10 個(gè)、國(guó)產(chǎn)仿制藥6個(gè)、改良型新藥1個(gè),覆蓋神經(jīng)、代謝、血液、心血管、皮膚等多種疾病治療領(lǐng)域,明確包含兒童適應(yīng)證的藥品有 11個(gè)。這些藥品極大提升了罕見病藥品的可及性,如4個(gè)進(jìn)口藥品直接填補(bǔ)我國(guó)相關(guān)疾病治療領(lǐng)域臨床空白,首個(gè)仿制藥醋酸艾替班特注射液獲批后,原研藥價(jià)格降低了 48%,減輕了罕見病患者的用藥負(fù)擔(dān),見圖1。
四、建議
4.1 罕見病藥品存在的問題
隨著改革的腳步不斷前進(jìn)、政策的紅利持續(xù)釋放,罕見病患者藥物可及性得到較大地改善,如佩索利單抗是首個(gè)獲批的進(jìn)口1類生物藥,企業(yè)在國(guó)際多中心臨床試驗(yàn)結(jié)束后同步向中國(guó)、美國(guó)和歐洲提交上市申請(qǐng),我國(guó)批準(zhǔn)時(shí)間僅比全球首次批準(zhǔn)(美國(guó))晚100 d。但是,與其他藥物對(duì)比,罕見病及罕見病藥品具有與一般醫(yī)療產(chǎn)品不同的特點(diǎn)和研發(fā)規(guī)律[10]:① 從發(fā)病規(guī)律角度,罕見疾病中很多是嚴(yán)重或危及生命的疾病,許多屬于先天遺傳性疾病且多始發(fā)于兒童期。② 從統(tǒng)計(jì)規(guī)律角度,罕見疾病的患者群體小,流行病學(xué)和疾病自然史等數(shù)據(jù)有限,醫(yī)療信息不充分,可能缺乏公認(rèn)的療效評(píng)價(jià)方法和研究終點(diǎn);疾病可能存在多種亞型,不同亞型患者的癥狀、體征、患病率及進(jìn)展模式等可能各不相同,患者可能呈現(xiàn)較高的異質(zhì)性,以兒童患者為主的臨床研究方法具有特殊性。③從研發(fā)成本角度,罕見病藥物開展臨床研究的機(jī)會(huì)有限,研發(fā)經(jīng)驗(yàn)較少,成功率低,上市后銷售范圍有限,投入產(chǎn)出比低。④ 從制度保障角度,罕見病的定義尚無(wú)統(tǒng)一規(guī)范標(biāo)準(zhǔn),有關(guān)規(guī)范性文件列舉出的罕見病種類較少,罕見病研究診療的前提基礎(chǔ)依舊薄弱。同時(shí),罕見病藥品加快審批制度雖然已經(jīng)建立,但在設(shè)立專項(xiàng)基金鼓勵(lì)企業(yè)研發(fā)、減免罕見病藥品生產(chǎn)企業(yè)研發(fā)費(fèi)用方面的相關(guān)保障措施仍然十分缺位。⑤ 從社會(huì)影響角度,罕見病兒童患者居多,且嚴(yán)重危及生命健康,因此罕見病不僅是個(gè)人健康問題,而且關(guān)系到整個(gè)家庭的穩(wěn)定和發(fā)展,關(guān)系到社會(huì)對(duì)兒童群體的關(guān)心關(guān)愛。這些獨(dú)特性凸顯出我國(guó)罕見病藥品在研究、生產(chǎn)、監(jiān)管、使用等環(huán)節(jié)還存在一些不足:① 罕見病基礎(chǔ)研究仍存許多空白,臨床資源有限,發(fā)病機(jī)制不明,② 企業(yè)對(duì)罕見病藥物研發(fā)投入不足、風(fēng)險(xiǎn)大、回報(bào)少。③ 患者對(duì)罕見病藥品需求迫切,希望有救命藥、便宜藥。④ 監(jiān)管部門要保障患者用藥安全、有效、可及,激勵(lì)企業(yè)投入研發(fā)生產(chǎn),促進(jìn)產(chǎn)業(yè)良性循環(huán)。
4.2 政策建議
4.2.1 制定罕見病藥品認(rèn)定標(biāo)準(zhǔn)
從部分國(guó)家和地區(qū)的經(jīng)驗(yàn)來(lái)看,通過(guò)立法對(duì)罕見病及罕見病藥品進(jìn)行界定,從發(fā)病率、患病率、藥品可及性等角度對(duì)罕見病及罕見病藥品進(jìn)行界定,為企業(yè)劃定更加精確的發(fā)力點(diǎn),精準(zhǔn)地釋放制度優(yōu)勢(shì),優(yōu)化資源配置有力地推動(dòng)了罕見病的保障機(jī)制的發(fā)展。
4.2.2 設(shè)立專門機(jī)構(gòu)負(fù)責(zé)罕見病藥物管理
目前我國(guó)的罕見病認(rèn)定、罕見病藥品的批準(zhǔn)、臨床使用、醫(yī)保保障等職能分散在國(guó)家衛(wèi)生健康委員會(huì)、國(guó)家藥品監(jiān)督管理局、國(guó)家醫(yī)保局等部門,且暫未設(shè)立常設(shè)工作機(jī)構(gòu)(或機(jī)制)。現(xiàn)有的管理方式可以充分發(fā)揮各部門的職能優(yōu)勢(shì),提高管理效率,但在強(qiáng)調(diào)分工的同時(shí),組織協(xié)調(diào)成本較高。建議設(shè)立專門機(jī)構(gòu)或建立常態(tài)化工作機(jī)制,對(duì)于罕見病及相關(guān)藥品統(tǒng)籌管理,打通研產(chǎn)用保通道。同時(shí),在統(tǒng)一歸口管理的制度下,完善對(duì)罕見病藥物的研發(fā)指導(dǎo)、審評(píng)技術(shù)標(biāo)準(zhǔn)體系、臨床開發(fā)資源等配套措施。
4.2.3 豐富針對(duì)孤兒藥研發(fā)的激勵(lì)政策
如免除監(jiān)管費(fèi)用、提供研發(fā)資助、提供協(xié)議援助、給予市場(chǎng)獨(dú)占期等。目前我國(guó)規(guī)定了罕見病藥品加快審批、減免稅額、納人醫(yī)保等制度保障措施,一定程度上較好地激勵(lì)了企業(yè)從事罕見病藥品的研發(fā)和生產(chǎn)。但對(duì)比發(fā)達(dá)國(guó)家或地區(qū)監(jiān)管機(jī)構(gòu)的激勵(lì)方式,仍存在一定的缺位和缺失。如罕見病藥品的市場(chǎng)獨(dú)占期制度,美國(guó)規(guī)定了7年,歐盟、日本規(guī)定了 10年。專利制度和數(shù)據(jù)保護(hù)制度都屬于知識(shí)產(chǎn)權(quán)保護(hù)的范疇,本質(zhì)上是給予創(chuàng)新者市場(chǎng)獨(dú)占的獎(jiǎng)勵(lì)。建議從鼓勵(lì)企業(yè)投人罕見病藥物研發(fā)、穩(wěn)定企業(yè)開發(fā)的市場(chǎng)預(yù)期角度,參照日本、歐盟做法,規(guī)定罕見病藥品上市后享有 10 年的市場(chǎng)獨(dú)占期,并對(duì)兒童罕見病藥品適當(dāng)延長(zhǎng),形成罕見病產(chǎn)業(yè)的良性循環(huán)。2022 年5月發(fā)布的《中華人民共和國(guó)藥品管理法實(shí)施條例(修訂草案征求意見稿)》對(duì)罕見病的市場(chǎng)獨(dú)占期予以相應(yīng)規(guī)定[11]。
參考文獻(xiàn)
[1]逯軍,潘翔.淺談我國(guó)罕見病的研究現(xiàn)狀與未來(lái)[J].中國(guó)熱帶醫(yī)學(xué),2023.23(2):109-114.
[2] 國(guó)家衛(wèi)生健康委員會(huì),科學(xué)技術(shù)部,工業(yè)和信息化部,等.關(guān)于公布第一批罕見病目錄的通知[EB/OL].(2018-05-11)2023-11-10].http://www. nhc.gov.cn/yzygj/s7659/201806/393:9a37139c4b458d6e830f40a4bh99.shtml.
[3] 李詩(shī)楊,殷彩琴,周楠,等.“互聯(lián)網(wǎng)+”背景下孤兒藥可及性提升策略研究--基于長(zhǎng)尾效應(yīng)[J].衛(wèi)生經(jīng)濟(jì)研究,2022.39(9)49 -52
[4] 國(guó)家市場(chǎng)監(jiān)督管理總局,藥品注冊(cè)管理辦法[EB/OL].(2020-01-22)[2023-11-10].http://scjgj.yibin.gov. cn/sy/xxgk/zcwj/202004/20200407 1260862. html.
[5] 張金子,宋曉琳,王澤釗,等.國(guó)外孤兒藥研發(fā)激勵(lì)機(jī)制對(duì)我國(guó)的倫理啟示[J].中國(guó)醫(yī)學(xué)倫理學(xué),2022,35(9):971 -977.
[6] 張海琴,李順平,馮俊超,等.典型國(guó)家罕見病醫(yī)療保障發(fā)展的歷史邏輯及相關(guān)啟示[J].中國(guó)醫(yī)療保險(xiǎn),2022(5):112-115.
[7] 國(guó)家藥品監(jiān)督管理局綜合司,中華人民共和國(guó)藥品管理法實(shí)施條例(修訂草案征求意見稿)[EB/0L].(2022-05-09)2023-11-10].https://www.nmpa. gov. cn/xxgk/zhqyjzhqyjyp/20220509220456183. html.
[8] 鄭建洪,邱春風(fēng),張真.基于 ClinicalTnals.sov 的中國(guó)罕見病目錄臨床試驗(yàn)注冊(cè)現(xiàn)狀分析[J],中國(guó)新藥雜志,2023,32(16):1600-1607.
[9] 周朋,任思寧,劉媛,等.中國(guó)已納人優(yōu)先審評(píng)審批程序的藥品注冊(cè)情況分析[J].中國(guó)新藥雜志,2024.33(6):534-542.
[10] 王曉建,罕見病精準(zhǔn)醫(yī)療:呼吁更多行動(dòng)[J].中國(guó)醫(yī)藥導(dǎo)刊,2022.24(1):29-32.
[11] 中華人民共和國(guó)藥品管理法實(shí)施條例(修訂草案征求意見稿)[EB/0L].(2022-05-09)[2023-11 -10]. https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyjyp/20220509220456183. html.

來(lái)源:中國(guó)新藥雜志


