您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2024-04-19 08:37
癌癥是一個重大的全球健康問題。它是全球主要死亡原因之一。根據美國癌癥協會2019年的統計數據,預計僅在美國就將發生約1,762,450例新發癌癥病例和606,880例癌癥相關死亡。可見抗腫瘤藥物發現和開發領域的研究規模巨大,在2023年,CDE批準化學藥品IND 1448件中,抗腫瘤藥物占了35.98%(圖1),而建議批準的化學藥品NDA 186件中,抗腫瘤藥物占了22.04%(圖2)。癌癥治療的負擔不斷增加,需要發現和開發新的抗腫瘤藥物,未滿足的臨床缺口依舊存在,雖然無論是國際巨頭還是Biotech都在投入巨大的資源在抗腫瘤藥物的研發上,但是抗腫瘤藥物的成功率多年來一直很低。
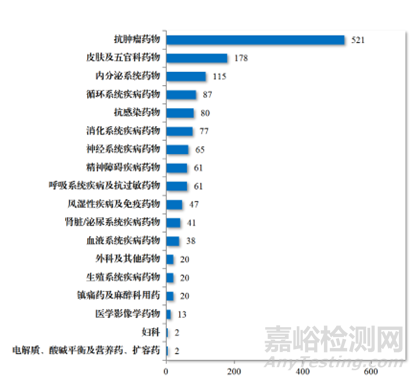
圖1.2023年CDE批準化學藥品IND適應癥領域分布情況(件)(參考文獻1)

圖2.2023年CDE批準化學藥品NDA適應癥領域分布情況(件)(參考文獻1)
據估計,每5,000-10,000種潛在抗腫瘤藥物中只有1種獲得FDA批準,進入I期臨床試驗的抗腫瘤藥物中只有5%最終獲得批準。在最近的一項研究中,發現新抗腫瘤藥物從I期到成功通過批準的總體概率低得令人無法接受,僅為3.7%。新抗腫瘤藥物失敗率如此之高的原因之一是其藥代動力學差,這主要源于其水溶性差。據估計,約75%的新藥開發候選藥物水溶性較差,其中許多是抗腫瘤藥物。
造成這個局面緣由主要是在抗腫瘤藥物發現過程中,很少關注候選藥物的理化性質。“納摩爾法則”在癌癥藥物發現中被廣泛采用。該規則涉及選擇具有納摩爾效力的化合物進行開發。該規則基于這樣的假設,即這些化合物在低劑量下是必需的且安全有效。該規則忽略了一個關鍵參數:這些化合物的物理化學性質,這會影響它們的藥代動力學不佳,從而影響它們的安全性和有效性。藥物研發關注點的失衡,厚此失彼,造成藥物從一個安全有效的極端走向了一個具有難溶性理化性質的另一端。很明顯的例子,在大多數體外實驗中,將藥物溶解在有機溶劑(而不是生理相關的水溶液)中,并評估其對細胞系的抗腫瘤活性。在臨床前階段,對水溶性差的抗腫瘤藥物沒有關注與強調。其次,抗腫瘤藥物的滲透性、活性和穩定性需要某些必不可少的疏水結構特征,這些特征使得藥物的水溶性較差。抗腫瘤藥物水溶性差的還有一個因素是藥物的結晶形式。晶型具有純度高、穩定性好等優點。新藥開發中優先選擇優勢晶型。然而,這樣的優勢晶型為了溶解,必須克服其晶格能壘,這是具有挑戰性的,很可能最終導致藥物溶出速度減慢。
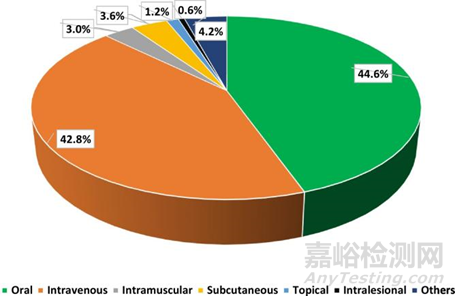
圖 3.2000 年至 2018 年間獲得美國 FDA 批準的腫瘤藥物產品,根據給藥途徑分類。(參考文獻2)
對2000年1月至2018年9月期間美國 FDA 批準的腫瘤藥物產品進行了調查。根據給藥途徑對這些藥物進行分類。圖3顯示了調查結果,在接受調查的167種腫瘤藥物產品中,口服給藥應然占據著最大的比例。口服是抗腫瘤藥物最優選的給藥途徑。它有幾個優點,例如易于管理和降低治療成本。口服給藥允許可行的連續給藥。口服化療成功的先決條件之一是獲得藥物可靠和一致的藥代動力學特征,從而實現最大的藥物療效和最小的毒性。但是一些挑戰與藥物的理化特性和胃腸道的生理學有關。這些挑戰限制了理想藥代動力學的實現,因此也限制了口服水溶性差的抗腫瘤藥物的藥效。所以也可以清楚看到,約42.8%是靜脈注射的。
據有關報道,大約40%的市場批準藥物和近70-90%的已發現分子的水溶性較差,這可能導致傳統制劑的生物利用度較低。隨著各種藥物遞送技術的引入,許多溶解度差、生物有效性低的藥物已被配制成成功的藥物產品。一個很明顯趨勢,最近在505(b)(2)項下的NDA文件的增加越來越重要。巨大的抗腫瘤藥物市場,巨大抗腫瘤藥物投入和申報上市,可是巨大的難溶性抗腫瘤藥物未能得到妥善的安置。
如何破局?
抗腫瘤藥物的平衡溶解度不僅取決于藥物與溶劑之間的相互作用,還取決于藥物固態內的分子間相互作用。大多數抗腫瘤藥物都以結晶狀態提供,具有很強的分子間相互作用。這些分子間相互作用導致強烈的晶體堆積,因此必須破壞它們才能溶解藥物。因此,抗腫瘤藥物固態下的晶體堆積是影響其溶解度的主要挑戰。抗腫瘤藥物可以存在多晶型現象。這些多晶型化合物具有相同的化學成分,但內部結構不同。當一種或多種溶劑或水分子摻入藥物晶格中時,就會形成溶劑化物或水合物。因此,抗腫瘤藥物可以以不同的多晶型物、溶劑化物或水合物的形式存在于固態下,這會影響其穩定性和溶解度。
甲苯磺酸索拉非尼表現出多晶型,它可以結晶成三種不同的晶型(即Mod I、Mod II和Mod III)。Mod I存在于相應的商業產品Nexavar®中。此外,根據其制備方法,甲苯磺酸索拉非尼可以結晶成不同的溶劑化物形式,這些溶劑化物具有不同的溶解度和化學穩定性。已經證明,甲苯磺酸索拉非尼晶型II的溶解度優于晶型I,但它是亞穩態的,具有物理不穩定性。一般來說,如果使用抗癌藥物的亞穩態結晶形式,它有轉變為熱力學穩定形式的傾向,從而加劇了水溶性差的問題。
無定形系統是制劑中一種很有前途的策略,因為它能夠提高水溶性較差藥物的溶出率和生物利用度。與結晶藥物相比,無定形藥物具有更高的自由能,從而改善了水溶性并維持了高過飽和度水平。所涉及的無定形材料具有熱力學亞穩態,可以轉化為更穩定形式的晶體。此外,它們通常被描述為一種玻璃狀和過冷液體,可以通過快速冷卻到達。當材料冷卻時,粘度增加,分子遷移率同時降低。該過程稱為溫度玻璃化轉變,該材料稱為玻璃。與無定形形式類似,玻璃是一種沒有晶體結構的脆性固體,也是亞穩態的,與藥物的結晶形式有關。使用數學方程來預測溶解度的增加。但是,實驗結果的值可能較低。由于其更大的自由能導致無定形形式具有更高的溶解度。
由于無定形藥物不穩定,容易重結晶。因此,添加聚合物等輔料對于固體制劑以抑制藥物再結晶是必要的。聚合物作為載體,通過其相互作用在提高溶解度和生物利用度方面也起著關鍵作用。它們可以穩定ASD系統,防止藥物通過藥物-聚合物之間的相互作用進行再結晶,并在各種加速條件下提高物理穩定性。無定形形式的藥物可以轉化為無定形固體分散體,從而提高其生物利用度。在此過程中,聚合物載體通過提高溶出速率、增強藥物溶解度、提高固態的物理穩定性發揮了重要作用。此外,它可以降低分子遷移率并提高玻璃化轉變溫度,從而在從晶體轉化為無定形形式的過程中提高穩定性。藥物-聚合物相互作用通過破壞藥物晶格之間的分子間相互作用來促進穩定。聚合物的存在改變了晶格的性質,進而影響了無定形固體分散體的穩定性。這種方法中生物利用度的提高是由熱力學和動能共同驅動的。
高分子載體材料空間位阻導致產生更大的表面積,這反過來又抑制了結晶并阻止了晶體生長的成核。溶出的第一步涉及分子的潤濕,這一過程由水溶性聚合物促進。盡管沒有達到完全的溶出釋放曲線,但過飽和溶液的產生和胃腸道轉運時間的改善增強了分子的吸收動力學。此外,無定形固體分散體(ASD)通過促進微粒、納米顆粒或膠束在胃腸道中的自發形成來提高滲透率。

圖4 抗腫瘤藥物開發的挑戰和不好的結果(參考文獻3)
案例分享
奧拉帕尼(olaparib)是多聚二磷酸腺苷核糖聚合酶抑制藥,獲得歐盟醫藥局和美國食品藥品管理局優先審查資格,于2014年12月批準上市,商品名LynparzaTM,用于治療婦女與BRCA基因缺陷相關的晚期卵巢癌。2017年8月17日,阿斯利康(AstraZeneca)奧拉帕尼Lynparza(olaparib)新型制劑片劑(原為膠囊)被FDA批準用于復發性上皮卵巢癌、輸卵管癌、或原發性腹膜癌成人患者(無論BRCA基因突變情況)的維持治療,這些患者在對當前的鉑類為基礎的化療處于完全緩解或部分緩解。除了適應癥的擴大,藥物的開發劑型也有膠囊轉變成片劑。劑量由從膠囊400mg,bid改為片劑300mg,bid,即由患者從每天早8粒晚8粒的大劑量吞服改為早2片晚2片的小量吞服,對患者的給藥順應性帶來了極大的便利。
奧拉帕尼是一種白色至淡黃色的不吸濕結晶粉末。活性物質結晶固體,在生理pH值范圍內具低溶解度,極微溶于水,溶解度僅為0.1mg/ml,單劑量50mg來算,化合物溶解也需要500ml介質,大于250ml,可以判定為難溶性藥物。化合物熔點接近200℃,LogP為1.96,為高熔點,低LogP化合物,可判斷熔點高,即晶格能較強限制化合物溶解,進而導致化合物體內生物利用度的問題。
為了提高病人服藥順應性,阿斯利康進行了固體分散體的開發。在片劑形式中,奧拉帕尼被迅速吸收,給藥后0.5至2小時達到最大血漿濃度。重復片劑給藥后,奧拉帕尼300mg或更高的穩態暴露與奧拉帕尼膠囊400mg劑量的穩定狀態暴露相匹配或超過,表明固體分散體技術可以極大的提高奧拉帕尼的生物利用度,降低每日給藥頻率和劑量,提高病人的順應性(表1)。
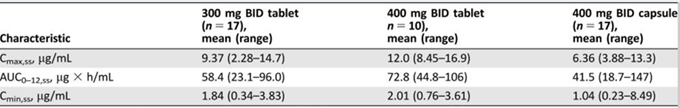
表1.奧拉帕尼膠囊和片劑在劑量擴展階段的藥代動力學和生物利用度的比較(參考文獻5)
總結
抗腫瘤藥物開發仍然是各大醫藥公司的研發重點,從申報上看亦是如此。但是,抗腫瘤藥物從發現之初,自身帶著特有的光環-藥物難溶性。在新藥申報的過程中,可能為了加速申報不會采取增溶的這種相對具有技術壁壘的技術。但是不得不說ASD技術通過提高水溶性較差的抗腫瘤藥物的溶解度,為腫瘤治療提供了潛在的益處,研發仍在繼續,即使想通過505(b)(1)快速推薦上市,仍然還能通過505(b)(2)去彌補遺憾。
參考文獻
1.2023年度藥品審評報告
2. Amorphous Solid Dispersion as Drug Delivery Vehicles in Cancer
3. Harnessing the therapeutic potential of anticancer drugs through amorphous solid dispersions
4.Insights on the Dissolution Evaluation and Optimization of Amorphous Solid Dispersions
5.奧拉帕尼片劑在卵巢癌患者中的給藥:實踐指導和期望

來源:藥事縱橫


