介入式人工心臟(介入泵)是近年來廣泛關注的一種臨時性循環輔助治療創新器械,可通過動/靜脈路徑,置于心室,將心室血壓泵入主動脈/肺動脈,輔助心室泵血功能,增強血液灌注,減少心肌氧耗,在短期內給與血液循環支持。目前探索的適應癥心源性休克、急性心肌梗死、高危PCI圍術期支持等。
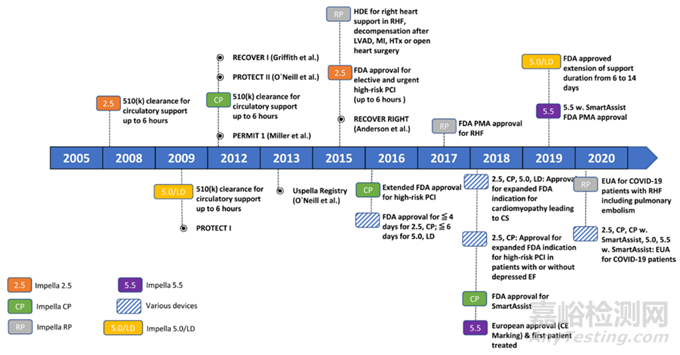
2024年3月21日,美國食品和藥物管理局(FDA)宣布一級召回,Abiomed將召回其針對Impella左側血泵的說明書。向所有受影響的客戶發送了新的和修訂的使用說明(IFU)。因為泵導管可能會刺穿(切割)心臟左心室壁。FDA 已將其確定為 I 級召回(最緊急的召回類型),使用或接觸違規產品將導致嚴重的不良健康后果或死亡。
此次召回(更正而非產品移除)美國近66390臺Impella系列介入心臟泵,召回系列包括Impella 2.5、Impella CP、帶SmartAssist的Impella CP、帶SmartAsist的Impella5.0、帶Impella 5.5和Impella LD。
目前已有129人報告嚴重受傷,其中包括49例與該公司召回相關的死亡事件。這并非是該公司首次嘗試對Impella設備進行召回。在2023年,Abiomed因其Impella設備被四次一級召回,包括本次事件。今年4月,該公司因泄漏清洗液的報告,對帶有SmartAssist系統的Impella 5.5進行了部分召回。而在今年6月,在凝血高于預期的情況下,Abiomed也對Impella RP Flex泵進行了召回。同時,該公司還警示心臟泵和經導管主動脈瓣置換(TAVR)支架之間潛在相互作用問題,并指出沿著設備外緣存在風險性連接到旋轉葉輪上的支架狀支柱可能會導致斷裂現象, 這種碰撞可能會導致通過損壞的Impella設備引起血液流失并將碎片傳播至血液中。隨后更新顯示此次召回案件中共發生四例死亡。
當前的召回作為一種糾正措施,而不是完全撤銷產品。從技術上講,它被FDA歸類為一級召回,允許繼續使用公告中提到的設備進行患者治療,前提是醫療保健專業人員遵守12月發布的緊急醫療設備糾正中新修訂的警告。更新的警告包括以下建議:
- 在手術過程中精確定位泵導管
- 在成像技術下推進或扭轉泵導管
- 在特定高危條件下或在主動CPR期間,在插入泵導管時要謹慎
- 回顧和熟悉這些更新的警告在設備的使用說明(IFU)
- 通知您所在機構的相關人員關于此次召回糾正,
- 通知任何其他已分發這些產品的機構關于修訂后的IFU。
Abiomed發送了一份關于I類召回的聲明。該公司表示:“為確保患者安全,我們已經對Impella系統的IFU進行了更新,以進一步解決罕見并發癥—左心室(LV)穿孔的潛在風險。”“我們通過更新IFU,在植入和重新定位方面提供了更加詳細和準確的技術指導,并強調了在植入Impella時需要考慮特定心臟和外周血管解剖結構。這份通知并非設備撤回,Impella心臟泵仍然可供患者使用。”
回顧整個事件,不同的人有不同的解讀,個人在創新的角度有幾個思考。
1、 在臨床上實踐中,面對心源性休克、急性心肌梗死缺血再灌注損傷、高危PCI的循環支持等問題,目前有各種臨時循環輔助裝置支持的策略,均沒有強力的臨床證據,因此在這方面有強烈的臨床需求。
2、在這些器械和治療策略中,有自己的作用特點和缺陷,解決這些問題高效的循環支持、血液相容性、操作簡便性等都是考慮的核心問題。
3、介入泵在臨床上探索了不同的適應癥,有其作用特點,在設計上要兼顧流量、介入尺寸、血液安全性、心肌組織安全性及操作簡便性等因素。理想的情況是小尺寸、大流量、血液影響小、心腔內位置相對固定、作用時與周邊組織機械作用力小。
4、針對不同的疾病,需要不同的設備,提供疾病治療需要的條件,進行支持治療,一種設備不好全面解決臨床痛點。
5、召回說明書的修改以及與TAVR支架的相互作用,說明在設計葉輪、支架結構、心腔固定定位、定位準確性等方面是進一步優化的方向。
6、任何創新的產品研發需要認真打磨每一個環節、細節決定成果,要認真消化吸收每一個結果,沉著應對遇到的每一個問題,面對有前景的應用,積極樂觀,不盲從、更不冒進,行穩致遠。