評估合成路線,側重于起始物質、中間體、試劑、催化劑、溶劑、副反應產物和降解產物等。對此,EMEA 建議“應基于扎實的科學評價,全面考慮參與合成的化學反應、原輔料中可能帶入新原料藥的雜質和可能的降解產物,確定最有可能在新原料藥的合成、純化和貯存期間出現的實際和潛在雜質。”
可能出現在API 中的潛在基因毒性雜質一般可分為以下幾類:
①未反應的具有警示結構的物料或中間體(如含氮雜環API 中未反應的硝基芳香化合物,由于不完全氫化作用或位置異構體無法環化)。
②與包含警示結構的物料、中間體或API 本身密切相關的物質(如在工藝中用鹽酸處理后的含羥烷基的API 的氯烷基類似物)。
③通過溶劑和試劑兩者之間的相互合成作用,或與原輔料或中間體的合成作用形成(如由于在磺酰氯的反應中,使用了異丙醇脫氧腺苷酸羥基中間體而形成了異丙醇甲苯磺酸鹽)。此外,在API 開發階段,風險評估還需考慮來源于生產期間或API 長期貯存期間的降解物。
2、基因毒性雜質的結構評估
EMEA 和FDA 指南草案都認為使用結構評估是一種有效的方法,可通過它進行基因毒性潛在性的評估。常用的結構評估商業軟件是DEREK和Mcase,這兩個系統費用昂貴,小公司也可使用基于Ashby 和Tennant 警示的簡單系統,詳見圖1。
3、基因毒性雜質的分類
一旦完成了結構評估,每個雜質應根據其基因毒性危害進行分類。Lutz Mueller 等確定的5 類分類方案已被廣泛用于這個目的,見表2。
此外,SAR 評估程序也是有缺陷的,采用SAR評估程序并不能全面覆蓋所有基因毒性雜質。因此需要根據安全性測試(Ames 測試),單獨評估這些雜質。如果雜質沒有基因毒性標記,但在工藝中作為親電試劑使用,仍需通過數據庫查詢確定其是否具有基因毒性,比如美國醫學圖書館提供的TOXNET 數據庫,可通過共同的門戶網站來訪問一系列數據庫,如有害物質數據庫(HazardousSubstances Databank,HSDB)、化學致癌作用研究信息系統(Chemical Carcinogenesis ResearchInformation System,CCRIS)和集成風險信息系統(Integrated Risk Information System,IRIS)等,提供了許多常見化學品的安全性數據。另一個相關的系統是Berkeley 數據庫。實際上,采用足夠的數據庫對化合物特定的成分進行基因毒性風險評估是經常的做法,而不是簡單使用TTC 限度進行控制。
4、雜質潛在遺留的風險評估
一旦確定具有潛在基因毒性的雜質,下一步就是考慮這些雜質帶入原料藥中的可能性。由于基因毒性雜質經常是高活性的,能夠通過下游工藝去除,因此,可以結合雜質的理化性質,在下游工藝處理中采用適當的方式把它們去除。例如,生產工藝中經常遇到的酸性、堿性條件下可分解或去除雜質,或者下游工藝中所用的其他試劑可與基因毒性雜質反應,使其不易反應,從而“安全”。以下針對基因毒性雜質的不同性質,提供可行的工藝去除方法。
4.1 反應活性
許多基因毒性雜質均具有高反應活性,例如酰鹵化合物,因其極易反應,使得在反應結果中監測它們幾乎無實際意義。而且,如果有任何殘留,可以通過某些方法有效地去除,如水淬滅或對所得產物的簡單水洗。
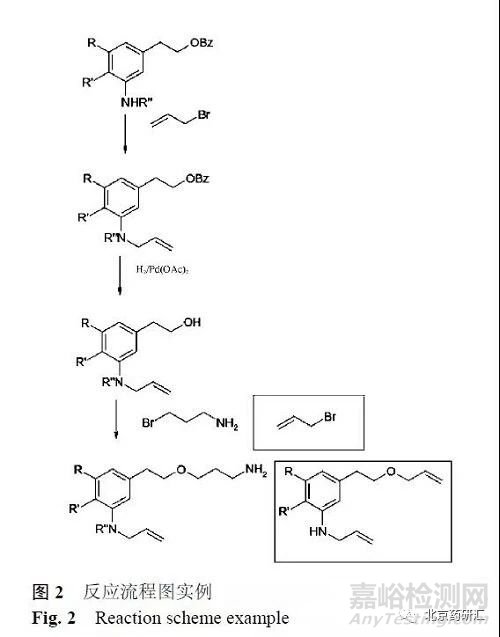
在工藝中,存在某些殘留物可能殘留在中間體中的可能性。對于這些化合物,在隨后的工藝步驟中具有高概率的反應,例如,在合成早期考慮使用烷基鹵,另一個烷化劑應在下游工藝中使用,則早期使用的烷基鹵殘留很可能消耗在后面階段,見圖2。該工藝中,第一階段用到的烯丙基溴殘留到第三階段,如果仍然存在,將反應生成預期產物的烯丙基類似物。
基因毒性化合物的反應活性可按表6 分類,該表只作為一個參考,具體情況應根據實際工藝的化學反應來評估。
4.2 溶解度-分離階段
許多高度親電(往往是基因毒性)的試劑、中間體常常用于優化產量和提高產品質量的合成工藝中,并常常在溶液中完成反應步驟。這便意味著基因毒性反應物很可能高度溶于所選擇的溶劑。因此,當工藝中將反應產物分離為固體時,基因毒性反應物被殘留在反應母液中而除去,這可進一步通過用一種基因毒性試劑易溶而反應產物不溶的溶劑洗滌濾餅,而徹底去除基因毒性反應物。這種情況下,基因毒性試劑的溶解度應在置換溶劑中評估,以便確定合適的清除因子。
4.3 揮發性
許多可能在典型的合成工藝中遇到的基因毒性物質是揮發性的,包括低分子量烷基鹵、醛、氮/硫鹵乙基芥。常用蒸餾方法來降低或完全去除存在的反應溶劑,因此也可有效地降低或消除殘留的基因毒性雜質。這取決于基因毒性相對于溶劑沸點的揮發性。
4.4 電離度
芳香胺是含能電離基團的潛在基因毒性物質的最好例子。大部分API 和中間體均具有潛在的電離。這種情況下,關注基因毒性物質和基質間可能存在的的電離度差異,便能通過改變水相的pH 值并萃取有機相,來降低基因毒性雜質的水平。
硝基化合物還原至胺便是此類工藝的一個很好的例子。雖然它們具有一個共同的基因毒性代謝物中間體(一個正氮離子),但是可能發現討論中的硝基化合物具有基因毒性,而其胺類似物則可能沒有。在這種情況下,需要去除硝基前體物,特別是如果相關的硝基化合物在下游工藝中不活潑,使得它可能以原形完成該工藝。
對于過量硝基化合物的去除,可以通過使用酸性水層的雙相系統,通過液液萃取來實現。任何非電離的硝基化合物將殘留在有機相中,而可電離的胺將殘留在水層中。棄去有機層,胺則在堿化后在新有機溶劑層中簡單地反萃取。
在合成常見的止痛藥對乙酰氨基酚中,倒數第二階段涉及將4-硝基酚還原至相應的胺,反應混合物用甲苯萃取,堿化,再萃取胺。
4.5 色譜法
從通過硅酸床的簡單過濾,到制備型液相色譜法,色譜法為API 或中間體中基因毒性雜質的去除提供了多種選擇。
制備型液相色譜法一般采用正相模式,即采用極性固定相(一般為硅酸)和非極性流動性(有機溶劑系統)。這與分析型液相色譜法不同,因為大部分分析色譜法都是在反相模式中進行的。制備型液相色譜法采用正相模式是出于分離化合物的需要——使用易被除去的揮發性溶劑。也可以使用反相模式,但是除去基于水性溶劑系統的困難限制了適用范圍。
Bandichhor 等報告了利扎曲坦的純化,利扎曲坦是一種5 羥色胺-HT 受體激動劑,其合成工藝中生成的基因毒性二聚合物雜質不能通過普通的工藝去除,通過分步結晶和重結晶工序,不能達到0.01%的限度。因此,使用適當的pH 值和離子強度改性來開發反相法,增加利扎曲坦和基因毒性二聚合物之間的選擇性。基因毒性二聚合物強烈地保留在柱子上,經過優化的負載率達到最大生產率,而沒有任何可察覺的基因毒性二聚合物帶入到產品中。作者報告了基因毒性二聚合物水平從約40 000 ppm 減少到40~80 ppm( 產率>95%)。
4.6 重結晶
重結晶是去除API 或中間體雜質,包括基因毒性雜質的最有效方法之一。采用該方法需要選擇一種適合的溶劑,使API 或中間體在高溫情況下高度溶解,而冷卻時幾乎不溶。高溫條件下通過過濾,去除不易溶于熱溶劑的雜質,而較易溶于冷溶劑的雜質保留在冷卻后的溶液中,通過過濾分離。
4.7 其他技術
除以上技術外,還可通過其他手段去除基因毒性雜質,如活性炭和樹脂。活性炭結合重結晶工藝,可非常有效地去除有色雜質。而樹脂去除法類似于萃取和分離技術,使基因毒性雜質吸附在樹脂上,而所需產品保留在溶液中,從而通過過濾除去雜質。
應用加標、清除法進一步風險評估除了述理論風險評估外,還需要通過加標清除法定量工藝對基因毒性雜質的實際去除能力。加標(spiking)指的是以固定的數量加入需要研究的基因毒性物質;清除(purging)指的是下游工藝去除目標雜質的能力。
一種新型的抗肌瘤產品,鹽酸帕唑帕尼的5 個潛在基因毒性雜質的分析控制策略見圖3(基因毒性雜質用盒括標識)。
討論中的雜質中的每一個以高水平(某些情況下高達5%)加標至工藝中。然后使用雜質預定命運圖以證明下游產品中水平的連續降低。例如,第1階段產品含670 ppm 化合物ii,第2 階段產品23 ppm,而第3 階段產品中間級API 和最終API含不到1.7 ppm(化合物ii)。這使他們集中于起始物料或中間體的上游控制,并避免需要在制劑中進行控制。這種方法的吸引力是它允許控制限度
設定在較高水平,并保證下游的清除將降低相關物質的水平至可接受水平。它也允許控制策略基于不太復雜和靈敏的分析方法,這些方法更與常規質量控制環境有關。