前 言
冷凍干燥是延長藥品保質期的重要工藝手段;
到2015年,凍干注射劑產品占所有新的注射劑藥品的近一半;
本篇文章將FDA從2015年 - 2019年收到的263個凍干注射劑產品(創新藥和仿制藥)中確定的制造相關缺陷進行分類;
本文在此僅討論OPMA收到的監管報告中確定的與制造商相關常見缺陷;
僅為申請人每個單元操作中常見缺陷;
并非對申請人需要進行的潛在研究進行全面討論;
為避免FDA發布大量缺陷,申請人應明確提供產品開發過程的詳細信息,以及如何利用開發數據和風險評估來減輕與商業制造過程相關的任何風險;
數據來源和研究方法:
從2015年到2019年,共收到263份凍干注射產品的規范提交文件,并在FDA的內部數據庫中搜索與制造相關的缺陷;
本研究調查了原始申請和修正案;
根據生產凍干注射產品所需的常用操作流程,OPMA發布的缺陷分為四類:
混合、過濾、填充和冷凍干燥;
每一類別缺陷以占與制造相關缺陷總數的百分比表示;
文中還提供了FDA發布的每個類別的缺陷示例(文中灰色底色部分);
需要注意的是,在過濾和下游過程中觀察到的與無菌保證相關的缺陷超出了本工作的范圍。
FDA從2015年 - 2019年收到的263個凍干注射劑產品(創新藥和仿制藥)
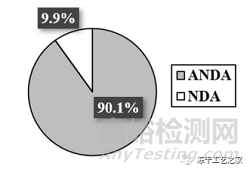
圖一:凍干注射劑提交文件中的制造相關缺陷
(在263份提交文件中約占83%,包括199個ANDA和19個NDA)
圖二:在多個操作單元觀察到多個缺陷
(缺陷占比之和,超過100%)
凍 干
導致凍干注射劑審批延遲的主要原因之一是不良的凍干工藝開發過程;
凍干工藝開發應包含對處方的全面表征;
獲得處方所對應的關鍵溫度:晶體處方的共晶點溫度Teu、無定形處方的最大濃縮溶液玻璃態轉變溫度Tg’、塌陷溫度Tc;
凍干工藝根據以上關鍵溫度進行設計;
差熱掃描量熱儀(DSC)確定處方的玻璃態轉變溫度Tg’,在對處方進行熱分析時需確定是否在預凍階段加入退火以降低由于溶質或水不完全結晶帶來的西林瓶破裂風險;
未能提供充分的必要數據來全面表征特定處方對應的凍干工藝設計過程將導致缺陷的發布;
在對申請人提交的熱分析數據重新審查的過程中,發現申請人對于DSC圖譜的錯誤解讀(例如將冰融化解釋為玻璃態轉變溫度);
在確定了處方的關鍵溫度后,申請人應根據關鍵溫度確定預凍和一次干燥階段使用的關鍵工藝參數;
雖然預凍以及預凍階段的成核過程可能對后續的干燥過程產生重大影響,但凍干注射劑的申報中,與預凍步驟相關的缺陷非常少出現;
非常要引起重視的是:申請人必須了解在用于注冊批或商業生產的凍干機上,是否能夠實現類似的預凍速率(設備性能限制);
最常見的凍干相關缺陷之一是:缺乏對一次干燥、二次干燥終點確定的合理解釋;
提前結束一次干燥進入二次干燥可能造成產品的塌陷或者回融,申請人應對一次干燥終點的確定給出充分的解釋和數據支持;
申請人很少在商業批放大中,監測產品溫度和其他凍干過程參數;
商業批過程中沒有足夠的控制策略的一個可能原因是適用于商業凍干機的過程控制技術非常有限(熱電偶溫度探頭、皮拉尼壓力計、壓力升測試等);
然而,有多種方法可以用于確定產品溫度和干燥終點(見文末文獻匯總);
二次干燥階段,需要注意由于升溫太快導致的產品塌陷;
不充分的二次干燥會導致產品水分過高從而引起產品在質保期內不穩定;
申請人應對二次干燥階段關鍵工藝參數有充分研究和認識;
藥品的玻璃態轉變溫度Tg隨著藥品水分升高而降低;
應對藥品目標含水量的確定做充分數據支持,以確保成品的玻璃態轉變溫度高于長期和加速條件下的存儲溫度;
在商業批放大過程中需要制訂科學的取樣計劃,以降低大型凍干機板層不同位置樣品差異帶來的產品風險;
取樣樣品需進行:外觀、水分、復溶時間這些和塌陷相關性很高的參數測試;
當商業生產沒有計劃繼續擴大規模時,應提供注冊批次的批次均勻性研究結果;
需要注意,實驗室凍干機開發的凍干工藝不一定適用于商業規模凍干機;
在完全了解設備工作能力的情況下,申請人應再次確認所有與批量相關的關鍵工藝參數(如:板層溫度、升降溫速率、保持時間、腔體壓力);
并提供基于數據和科學方法的放大策略,以確保產品在實驗室規模和生產規模之間有相同的熱歷史;
從實驗室規模到生產規模放大時,不應忽視傳熱特性(如西林瓶傳熱系數、腔體局部壓力變化以及預凍速率差異的影響);
申請人應了解凍干機裝載量(部分裝載/滿載)不同帶來對產品的影響;例如:凍干機裝量變化是放大過程中的一個重要過程變量,在商業生產中應降低與潛在過載相關的風險;
與凍干相關的常見缺陷示例:
我們注意到申報批的凍干工藝參數會直接應用到商業批,未考慮此轉移的批量變化;
申報批應用的凍干工藝關鍵參數(如:板層溫度、升降溫速率、腔體壓力)在批量變化后,仍然可以生產出符合質量指標的產品。需要提供充分科學的依據;
商業放大使用的凍干機,需要提供每個托盤內裝載西林瓶數量、每個板層上托盤數量、以及凍干機使用的總板層數量信息;
證明放大批量后,是否使用合理的方式重新確定一次干燥終點;
凍干機的裝載量限制(工作能力限制)是凍干工藝開發和放大過程中的重要變量,根據目前使用凍干機的工作能力以及當前裝量說明如何在商業生產批次中降低與凍干機過載(chocked flow、冷阱過載等)相關的風險;
提供用于預期商業批次的詳細取樣計劃,以充分獲取每個板層上不同位置西林瓶在藥品關鍵質量屬性方面的變化或一致性數據。此外,通過相應的抽樣計劃來修訂主批次記錄;
請提供為藥品進行凍干工藝開發的相關過程數據。凍干的關鍵工藝參數,如:板層溫度、腔體壓力是如何確定的。解決以下與所提交凍干工藝參數確定的相關問題:
解釋一次干燥階段的板層溫度是如何去頂的,其跟玻璃態轉變溫度(Tg’)、塌陷溫度(Tc)之間的關系。同時提供熱分析數據來支持此參數確定的合理性;
提供申報批的凍干工藝曲線圖,包含板層溫度及腔體壓力數據;同時提供壓力升數據,以解釋一次干燥、二次干燥終點確定的合理性;
分別提供申報批工藝研究階段和商業批的詳細批量信息:每個托盤上西林瓶數量、每個板層的托盤數量、使用的板層數量;
為商業批次提供詳細的取樣計劃,以充分獲取每個板層上不同位置的西林瓶在藥品關鍵質量屬性方面的變化或一致性;
退火步驟可以促進甘露醇結晶(消除甘露醇重結晶),從而最大限度降低西林瓶破裂的風險;我們注意到你提供的凍干工藝不包含退火步驟,請說明采取了那些控制措施(如果有的話),以降低凍干和存儲過程中西林瓶破裂的風險;
最后的話:
配液、過濾、灌裝、凍干四個工藝階段中,與凍干相關的缺陷數量是最多的;
以上缺陷,看起來各自獨立,但背后都是要求申請人對凍干工藝的原理、設備和過程有深刻的認識。