1�����、監(jiān)管機(jī)構(gòu)����、ICH����、USP已經(jīng)重視方法的生命周期管理理念
在現(xiàn)代流程管理中,生命周期概念越來越重要。它側(cè)重于從投資到運(yùn)營到淘汰的全部成本,近年來這個(gè)概念也應(yīng)用于分析方法�����。分析方法的生命周期包括設(shè)計(jì),開發(fā),驗(yàn)證(包括儀器校正、方法學(xué)驗(yàn)證和方法轉(zhuǎn)移)和方法的終止。
監(jiān)管機(jī)構(gòu)也增強(qiáng)了對分析方法生命周期的管理意識����,因此�,國際人用藥品注冊技術(shù)協(xié)調(diào)會(ICH)以及美國藥典論壇討論納入包括分析方法生命周期管理的新指南����,美國藥典驗(yàn)證組和專家驗(yàn)證組已經(jīng)提出了將一個(gè)新的通用章節(jié)(1220)“分析方法的生命周期“整合到美國藥典(USP)中。而且��,在非監(jiān)管環(huán)境下�,對生命周期管理的關(guān)注度也越來越高。
基于方法開發(fā)的結(jié)果增加了方法的耐用性�����,因此��,減少方法學(xué)驗(yàn)證和審批后變更的工作量��,以及最小化不規(guī)范結(jié)果的風(fēng)險(xiǎn)有助于降低該方法在其生命周期中的成本。
2���、USP1220分析方法的生命周期
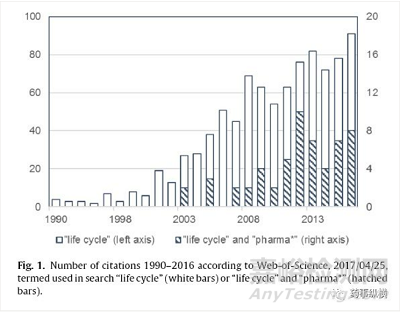
分析方法生成的數(shù)據(jù)應(yīng)用于各種領(lǐng)域。這些數(shù)據(jù)是決策的依據(jù)���,因此,數(shù)據(jù)有效性是非常重要的,方法需要能夠穩(wěn)定地提供這些數(shù)據(jù)。在Web-of-Science的數(shù)據(jù)庫中搜索“生命周期管理”主題,科學(xué)文獻(xiàn)中首次提及“生命周期管理”的概念是在1950年���,加拿大國防總部Baglow指出生命周期管理的重點(diǎn)是設(shè)備或系統(tǒng)運(yùn)營的總成本��。在接下來的幾年里��,隨著關(guān)注度的提高,有關(guān)科學(xué)出版物也越來越多�,如圖1所示����?�?傊?���,在Web-of-Science數(shù)據(jù)庫中搜索到940份手稿���,在我們的審查中��,我們關(guān)注于制藥領(lǐng)域的方法即化學(xué)方法���,使用關(guān)鍵詞“生命周期管理”和“制藥”進(jìn)行搜索�����,獲得了58篇文章,第一次出版日期是2003年(圖1)���,在“化學(xué)分析”類別中搜索“生命周期管理”,14篇文章被識別�����。
圖1:根據(jù)Web-of-Science數(shù)據(jù)庫中1990-2016年的引文數(shù)量��,2017/04/25,關(guān)鍵詞搜索“生命周期”(白色條)���,“生命周期”和“制藥”(陰影條)。
分析方法生命周期概念�����,如圖2所示��。它包括質(zhì)量源于設(shè)計(jì)(QbD)中方法開發(fā)����,驗(yàn)證和使用����,可能被視為方法開發(fā)和方法驗(yàn)證之間的聯(lián)系[2,3]��。
圖2:分析方法的生命周期管理
到目前為止,關(guān)于分析生命周期的四篇代表性文章已經(jīng)在美國藥典論壇發(fā)表[4-7]:
分析方法的生命周期管理:方法開發(fā)���,程序評估和程序驗(yàn)證
適用性:決策標(biāo)準(zhǔn)和目標(biāo)測量不確定度
分析控制策略
分析目標(biāo)方案:整個(gè)分析生命周期的結(jié)構(gòu)和應(yīng)用
最近,美國藥典驗(yàn)證組和專家驗(yàn)證組已經(jīng)提出了將一個(gè)新的通用章節(jié)(1220)“分析方法的生命周期“整合到美國藥典(USP)中[8]�����。在現(xiàn)代生命周期模型概念的轉(zhuǎn)變過程中����,對基于工藝驗(yàn)證的分析方法進(jìn)行了討論,在整個(gè)方法的所有階段�,綜合考慮方法和風(fēng)險(xiǎn)管理�����,以確保有效的數(shù)據(jù)生成和提高方法的可靠性��。
將生命周期管理概念應(yīng)用于分析方法提供了一個(gè)機(jī)會�����,使用從科學(xué)和質(zhì)量風(fēng)險(xiǎn)管理的應(yīng)用獲得的知識來持續(xù)改進(jìn)和保證數(shù)據(jù)質(zhì)量。分析方法生命周期管理包括分析方法開發(fā)��、改進(jìn)��、評估���、驗(yàn)證����、轉(zhuǎn)移和與藥品生產(chǎn)質(zhì)量管理規(guī)范(GMP)相關(guān)的維護(hù)[15]�。分析方法的生命周期方法充分利用了QbD,是現(xiàn)有指南的延伸[6]�����。
3��、分析方法目標(biāo)(ATP)
正如馬丁等人在其代表性文章[8]中所述的“分析方法生命周期的一個(gè)基本組成部分是有一個(gè)規(guī)定分析方法的性能要求的目標(biāo)���,這些要求描述在ATP���。
ATP可以被看作是分析方法生命周期的一個(gè)參考點(diǎn)��,自1998年以來,“設(shè)置分析要求”已經(jīng)在Eurachem指南[16]中被提到(圖3),它與ICH Q8中的質(zhì)量目標(biāo)產(chǎn)品概況(QTPP)相當(dāng)[12]�����,但轉(zhuǎn)移到分析方法或ICH Q5E [17]中提到的關(guān)于生物技術(shù)產(chǎn)品的關(guān)鍵質(zhì)量屬性(CQA)�。ATP是分析方法需要的書面記錄�,應(yīng)該建立在方法開發(fā)之前,并與方法的目的相關(guān)聯(lián),而不是與特定的分析技術(shù)相關(guān)聯(lián)��。這意味著任何符合ATP的分析方法都是可以接受的[18]��。

圖3:在分析目標(biāo)方案(ATP)中描述的方法開發(fā)和驗(yàn)證過程
ATP標(biāo)準(zhǔn)應(yīng)基于分析方法的預(yù)期用途���,用戶規(guī)范或法規(guī)要求和指南可作為ATP的基礎(chǔ)�����。如果沒有預(yù)先設(shè)定外部參數(shù),實(shí)驗(yàn)室應(yīng)選擇合適的方法(ISO / IEC17025,5.4.2)。在定量方法的情況下�,ATP常?�;谀繕?biāo)測量不確定度(TMU),這是可報(bào)告結(jié)果中的最大可接受的不確定性,必須通過方法來確定[4,19]�。TMU轉(zhuǎn)移到定性方法中也可以是限度和檢測能力[20]��。
因此,合規(guī)性評估的關(guān)鍵是“決策規(guī)則”的概念,基于測量的數(shù)量值的不確定性和規(guī)定的限制�����,考慮到可接受的錯(cuò)誤決策的概率���,給出了一個(gè)產(chǎn)品的接受或拒絕的方案[4,19]。決策規(guī)則的概念也在共識標(biāo)準(zhǔn)文件中被描述,例如美國機(jī)械工程師學(xué)會(ASME)的“決策規(guī)則指南”�����,Eurachem 指南“在合規(guī)性評估中使用不確定性信息”和國際標(biāo)準(zhǔn)化組織(ISO)的“測量不確定度表示指南(GUM)”[21-23]���。
取決于方法的預(yù)期用途���,方法的典型要求可以包括性能準(zhǔn)則的準(zhǔn)確度����、精密度�����、專屬性�、靈敏度����、線性和/或耐用性,但也包括樣品周轉(zhuǎn)時(shí)間����、吞吐量����、分析總成本和操作簡便性����。
作為藥物雜質(zhì)方法的ATP的一個(gè)例子,Barnett等[6]基于藥物在雜質(zhì)和賦形劑存在下準(zhǔn)確量化藥物的要求�,提出了100.0%±3.0%的準(zhǔn)確度和≤1.0%的精確度�。一旦ATP被定��,分析人員對最可能提供符合ATP的分析數(shù)據(jù)/結(jié)果的分析方法進(jìn)行選擇�����。隨后,生命周期可以繼續(xù)方法設(shè)計(jì)和風(fēng)險(xiǎn)評估。作為先決條件���,ATP應(yīng)用在分析方法生命周期的各個(gè)階段,如圖2所示[6]。
4、方法的設(shè)計(jì)
分析方法的生命周期的下一步是方法的設(shè)計(jì)����。為了完成方法開發(fā),了解方法基礎(chǔ)是非常重要的��,關(guān)鍵變量如何影響分析是必需的[62]���。此外�,重要的是在開發(fā)階段要考慮全面,包括樣品制備和準(zhǔn)備參考方案[24]以確保最終方法是穩(wěn)定的和適合于目的的�����。因此���,方法設(shè)計(jì)不會只考慮ATP�,還要考慮分析室的能力和教育水平,結(jié)合以下主題����,方法開發(fā)���,方法設(shè)計(jì)被馬丁等人認(rèn)為是生命周期的第一階段[8]��。
5、分析方法的開發(fā)
方法開發(fā)中的策略受到方法設(shè)計(jì)過程中選擇的分析類型的強(qiáng)烈影響���。適用于復(fù)雜樣品的樣品制備方案通常對于方法的結(jié)果至關(guān)重要。當(dāng)嘗試太少時(shí),可能會遇到不良或不可重現(xiàn)以及方法耐用性問題,增加方法轉(zhuǎn)移的難度��,甚至縮短儀器壽命[24,25]��。大多數(shù)分析技術(shù)需要分析物為均一溶液��,因此固體樣品的溶解是必要的�。只有一些技術(shù)如拉曼或近紅外(NIR)光譜可以直接分析固體樣品[26,27]�����。樣品制備的其他步驟可能是為了減少基質(zhì)成分,并提高整個(gè)方法的專屬性���。生物分析樣品通常需要在分析前進(jìn)一步濃縮分析物或者有時(shí)還要分離偶聯(lián)物。常見的樣品制備步驟包括(支持的)液 - 液相或固相萃取����,免疫凈化�,水解�,有時(shí)還需要分析物的衍生化(例如包含熒光團(tuán)等)。藥物產(chǎn)品和生物分析方法的不同樣品制備技術(shù)的總結(jié)在文獻(xiàn)中可以找到[24,28-40]����。
在目前的制藥應(yīng)用中以高效液相色譜法(HPLC)為基礎(chǔ)的方法被認(rèn)為是最相關(guān)的分析技術(shù)�����,文章中用它們來舉例說明不同的可能性。基于類比來完成其他技術(shù)的轉(zhuǎn)移�。
5.1 用于方法開發(fā)的儀器
HPLC系統(tǒng)有幾個(gè)組件可用于方法開發(fā)[41]��。HPLC系統(tǒng)可以是模塊化的或整體,利用等度或梯度洗脫,方法開發(fā)中的關(guān)鍵步驟是流動相和柱子篩選�����,用于進(jìn)一步方法優(yōu)化的起始系統(tǒng)包括梯度溶劑輸送器����,溶劑比例閥,帶有用于多列選擇的閥的柱溫箱��,自動進(jìn)樣器�,如果可能的話,多種檢測器功能���,包括二極管的多種檢測器功能陣列和質(zhì)譜。
這個(gè)系統(tǒng)是能夠提供流動相(通常是3種有機(jī)溶劑和6種不同pH值的緩沖液)組成不同極性��,pH值和四根及以上色譜柱不同柱溫運(yùn)行[42]�����。另外不同的檢測器可能有助于識別分析物并在ATP中評估最佳的選擇。即使不會是最終的方法,質(zhì)譜檢測也可用于峰值跟蹤�����。
Snyder等人提出的疏水性減影模型(產(chǎn)品質(zhì)量研究所(PQRI)方法)可以評價(jià)任何選定的等效和/或正交色譜柱[43]�����,超過650根已經(jīng)通過測試�����,表征已添加到數(shù)據(jù)庫[44]。該數(shù)據(jù)庫可在USP網(wǎng)站上獲得[http://www.usp.org/pqri-approach-column-equiv-tool����,17/04/24訪問]�。
通常�,HPLC系統(tǒng)至少可用30年,通過引進(jìn)超高效液相色譜(UHPLC)系統(tǒng)取得了顯著的進(jìn)步,由于它們的操作壓力高達(dá)20,000psi(1300bar)�����,這些系統(tǒng)允許使用填充2μm顆粒的色譜柱[45-56]�。即使常規(guī)方法很少以真正的超高壓運(yùn)行,UHPLC系統(tǒng)仍被認(rèn)為是方法開發(fā)實(shí)驗(yàn)室的標(biāo)準(zhǔn)設(shè)備,主要是由于減少了系統(tǒng)分散和駐留體積以及提高了精密度和靈敏度(10)��,此外��,分析速度更快�����,溶劑消耗量更低,量化限值更低[57]���,這也符合成本控制中在經(jīng)濟(jì)環(huán)境中獲得更好和更快信息的要求[58]。
5.2 傳統(tǒng)的方法開發(fā)方法
戰(zhàn)略性方法開發(fā)取決于知識和樣本的復(fù)雜性����,分析師的經(jīng)驗(yàn)和直覺��,材料的可用性,如柱子和溶劑����,以及目標(biāo)物的分離度�����。關(guān)鍵的方法參數(shù)的確定需要專注于相關(guān)的實(shí)驗(yàn),在過去,選擇最終分離的條件(方法開發(fā))通常是采用試錯(cuò)法[59]���,例如通過單因素考察(OFAT)檢測分離度直到找到合適的方法。這種方法非常耗時(shí),特別是在那些多個(gè)參數(shù)被確定為方法開發(fā)的關(guān)鍵參數(shù)的情況下。這通常會導(dǎo)致非常多的實(shí)驗(yàn)作為合理方法開發(fā)的基礎(chǔ)��。另外����,這個(gè)方法往往會不耐用(“新”峰,其他峰的消失和臨界峰值的變化)��,特別是在轉(zhuǎn)入另一個(gè)實(shí)驗(yàn)室時(shí)�,并未考慮色譜參數(shù)(因子)之間的作用[60-62]。
因此�,傳統(tǒng)的方法開發(fā)策略有很高的失敗的風(fēng)險(xiǎn)(例如�,不確定的不規(guī)范結(jié)果)���,并且在方法轉(zhuǎn)移或替代方法時(shí)總是需要方法的重新驗(yàn)證�,從而可能會導(dǎo)致方法成本的增加[63]�。
因此,需要開發(fā)色譜條件���,以更系統(tǒng)的方法篩選色譜柱和流動相,以獲取有關(guān)參數(shù)并設(shè)定分離的最優(yōu)條件����。
5.3 系統(tǒng)的方法開發(fā)
與傳統(tǒng)方法相比��,更為系統(tǒng)化的方法是使用統(tǒng)計(jì)方法和軟件輔助工具作為方法開發(fā)中快速有效的工具�����。在過去的幾年中,對系統(tǒng)的方法開發(fā)策略進(jìn)行了大量的研究[41,64-68] ���,F(xiàn)DA中的“21世紀(jì)制藥業(yè)動態(tài)藥品生產(chǎn)質(zhì)量管理規(guī)范(cGMPs)-基于風(fēng)險(xiǎn)的方法”也建議采用系統(tǒng)的方法[69]。在FDA確定藥品生產(chǎn)問題尚未完全明了的情況下�����,新的最先進(jìn)的技術(shù)的實(shí)施是比其他行業(yè)慢[70,71]�����。該舉措導(dǎo)致ICH發(fā)布了一系列新的指導(dǎo)方針:
2005年發(fā)布的ICH準(zhǔn)則Q8和Q9����,為藥物開發(fā)和風(fēng)險(xiǎn)管理提供了指導(dǎo)���,而2008年發(fā)布的Q10描述了一個(gè)全面的綜合藥品質(zhì)量體系[10-12]�����。2012年,增加了關(guān)于原料藥開發(fā)和生產(chǎn)的Q11指南[13]。這些指南旨在以更科學(xué)和風(fēng)險(xiǎn)為基礎(chǔ)的方法,使制藥行業(yè)的藥物開發(fā)和生產(chǎn)方法現(xiàn)代化[72]�。雖然ICH準(zhǔn)則Q8沒有明確提及分析方法的開發(fā)���,但是在藥物開發(fā)中要求使用QbD方法��,這也可以看作是推薦QbD分析方法的����。正如修訂后的ICH準(zhǔn)則Q8(R2)所定義的����,“系統(tǒng)的方法開發(fā)是以預(yù)定目標(biāo)開始,基于完善的科學(xué)和質(zhì)量風(fēng)險(xiǎn)管理���,強(qiáng)調(diào)產(chǎn)品、過程的理解和過程控制“[12] ��。QbD是由Joseph Juran[73]首先提出的一個(gè)概念�,他指出“產(chǎn)品特征和故障率在很大程度上取決于質(zhì)量計(jì)劃”,這意味著質(zhì)量必須被設(shè)計(jì)成一個(gè)產(chǎn)品或一個(gè)過程���,不能被測試。
QbD概念可以擴(kuò)展到分析方法��,并以系統(tǒng)的方法得到結(jié)果����,包括方法目標(biāo)的定義,風(fēng)險(xiǎn)評估�,設(shè)計(jì)空間(DS)的制定,實(shí)施控制策略和持續(xù)改進(jìn)增加方法的耐用性和知識(圖4)。為了將這與QbD概念區(qū)分開來,在最近的出版物中通常被稱為分析質(zhì)量源于設(shè)計(jì)(AQbD)[63,74-83]。
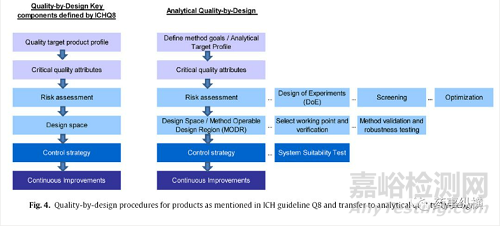
圖4:ICH準(zhǔn)則Q8中提到的產(chǎn)品質(zhì)量設(shè)計(jì)程序,轉(zhuǎn)換為質(zhì)量設(shè)計(jì)的分析方法
AQbD包括一個(gè)早期的以明確確定影響分析方法性能的方法參數(shù)的風(fēng)險(xiǎn)評估����,但也包括與樣品制備,儀器配置和環(huán)境條件等變異相關(guān)的風(fēng)險(xiǎn)[63]。質(zhì)量風(fēng)險(xiǎn)管理(QRM)過程在ICH Q9指南[11]中有詳細(xì)描述,包括風(fēng)險(xiǎn)評估和風(fēng)險(xiǎn)控制。風(fēng)險(xiǎn)評估通過使用“魚骨”(Ishikawa)圖表或失效模式影響分析(FMEA)和優(yōu)先矩陣(PM)���,在分析方法的開發(fā)的不同階段中評估對方法性能影響最大的方法因素,并定義哪個(gè)需要進(jìn)一步調(diào)查[72,84,85]。
使用QbD方法��,系統(tǒng)方法開發(fā)的基本原理沒有改變�����。然而��,通過實(shí)驗(yàn)設(shè)計(jì)(DoE)策略,為該方法設(shè)計(jì)的質(zhì)量需求有所增加�。早期風(fēng)險(xiǎn)評估的引入有助于確定關(guān)鍵的分析參數(shù)��,并專注于方法開發(fā)[60,86]。更深入的了解在實(shí)驗(yàn)室中我們正在做什么以及為什么我們這樣做是必需的。這個(gè)想法是在方法的早期階段投入更多的時(shí)間���,考慮全面和良好的科學(xué)知識,防止以后出現(xiàn)問題(例如,由于該方法的不耐用性導(dǎo)致的經(jīng)常性不確定的不規(guī)范結(jié)果)[6,87] ���。
這種方法的新穎性和前景是,特定方法的設(shè)計(jì)空間(DS)或方法可操作設(shè)計(jì)區(qū)域(MODR)內(nèi)的修改,可以被看作是調(diào)整而不是(批準(zhǔn)后)改變[60,85]。
5.3.1 基于化學(xué)計(jì)量的方法開發(fā)
在全部或部分因子設(shè)計(jì)中���,進(jìn)行一組實(shí)驗(yàn)(DoE),其中同時(shí)改變一個(gè)或多個(gè)因子,使用統(tǒng)計(jì)工具�,可以計(jì)算每個(gè)因子對分離度的影響���,數(shù)據(jù)用于在一個(gè)方法中尋找最佳條件���。典型的例子是Plackett-Burman設(shè)計(jì)的廣泛使用����,這個(gè)設(shè)計(jì)說明了不同因素之間的相互依賴關(guān)系����,只有在這個(gè)設(shè)計(jì)中包含了一系列因素才需要多步驟的方法。作為替代中心組合Rechtschaffen和Box-Behnken設(shè)計(jì)可用于方法開發(fā)[82,83,88-95]�����。Rakic等[93]發(fā)現(xiàn)中心組合設(shè)計(jì)優(yōu)于兩個(gè)和三個(gè)全因子如Box-Behnken在色譜方法開發(fā)中的設(shè)計(jì)���。他們獲得了更好的模型���,同時(shí)減少了實(shí)驗(yàn)所需的模型數(shù)量���。
通過使用DoE(例如全部或部分因子設(shè)計(jì)�����,Plackett-Burman設(shè)計(jì))���,最重要的參數(shù)(影響因子)被同時(shí)優(yōu)化����,以評估個(gè)別和組合的關(guān)鍵參數(shù)的影響���。例如�����,兩個(gè)(n)水平的方法參數(shù)導(dǎo)致8個(gè)(E = np)實(shí)驗(yàn)運(yùn)行[18]���。
DoE的輸出導(dǎo)致了一個(gè)全面的操作條件區(qū)域�����,即所謂的設(shè)計(jì)空間(DS)或方法可操作設(shè)計(jì)區(qū)域(MODR)[12,63,72,80,81,96-102]的識別。
在DS(orMODR)方法中選擇一個(gè)工作點(diǎn)后���,執(zhí)行驗(yàn)證以確認(rèn)該方法滿足先前定義的方法目標(biāo)(分析目標(biāo)方案��,ATP)的要求�,進(jìn)一步的方法驗(yàn)證應(yīng)嚴(yán)格符合法規(guī)[103 ] ����。
基于化學(xué)計(jì)量學(xué)的方法開發(fā)程序是通用方法,并且也可用于反相(RP-)HPLC以外的方法的開發(fā)[75,82,83,94,95,104-112]�,即其他色譜���,還有電泳���,光譜或生物化學(xué)方法[113-121]�����。
5.3.2 建模軟件輔助方法開發(fā)
作為方法開發(fā)的替代方法,可以使用輔助軟件來預(yù)測選定條件下的色譜圖[122]����。專門為RP-HPLC方法開發(fā)設(shè)計(jì)的市售溶液的例子是DryLab�,F(xiàn)usion LC方法開發(fā)�����,ChromSword�,ACD/AutoChrom或ACD / LC模擬器�����?�;谏贁?shù)實(shí)驗(yàn),當(dāng)改變流動相組比例���,pH值��,溫度�,流速或柱尺寸和粒徑時(shí)���,這些軟件可以預(yù)測反相液相色譜中峰的移動和分離度[60,96,123–129]���。
5.4基于分析物方法開發(fā)的預(yù)測
HPLC方法開發(fā)的另一個(gè)策略是基于分子結(jié)構(gòu)或物理化學(xué)性質(zhì)����,例如樣品組分的logP,logD和pKa來估計(jì)它們的保留時(shí)間和最佳分離條件[65,130,131]。
早在20世紀(jì)80年代�����,在科學(xué)文獻(xiàn)[132-134]中就討論了色譜保留時(shí)間的預(yù)測�。近年來�����,許多出版物記錄了對保留時(shí)間的預(yù)測[77,131,135-164]。定量結(jié)構(gòu)活性(QSAR),性質(zhì)(QSPR)或保留關(guān)系(QSRR)可以為保留時(shí)間的預(yù)測提供基礎(chǔ)[77,135,141-147,152]�。
隨著代謝組學(xué)或一般非目標(biāo)分析的興起��,基于結(jié)構(gòu)的保留時(shí)間預(yù)測獲得更多的興趣。即使AMMS能夠通過其化學(xué)組成鑒定化合物,并最終通過串聯(lián)質(zhì)譜MS的片段分配而給出結(jié)構(gòu)信息��,在這種情況下使用HPLC連接到AMMS/ MS�����,仍然可能有許多異構(gòu)化合物不能區(qū)分�。為了進(jìn)一步減少大多數(shù)確定性鑒定的潛在候選數(shù)量(等級1 [165])��,基于結(jié)構(gòu)的保留時(shí)間預(yù)測可能具有很大的價(jià)值[143,144,147,149,166-168]����。
6�����、分析方法的驗(yàn)證
在方法開發(fā)之后,方法驗(yàn)證是必需的���。它被Martin等人[8]稱為生命周期的第二階段。ICH指導(dǎo)原則Q2“分析方法的驗(yàn)證:正文和方法論”[103]推薦了藥物分析方法�����。根據(jù)FDA指南[9]中的術(shù)語�,“方法驗(yàn)證”也稱為“方法性能驗(yàn)證”。為了更好地符合FDA的“cGMPs-基于風(fēng)險(xiǎn)的方法”和ICH 指導(dǎo)原則Q8�、Q9���、Q10���,該指南于2011年進(jìn)行了修訂����,并構(gòu)成了產(chǎn)品生命周期概念[10-12,69]����。
如前所述,過程質(zhì)量管理和方法驗(yàn)證[16-172]都可以從產(chǎn)品生命周期的概念中受益。因此,Ermer和Ploss [171]將方法驗(yàn)證定義為“數(shù)據(jù)的收集和評估,方法設(shè)計(jì)階段的知識貫穿其使用周期�����,并建立科學(xué)證據(jù)����,證明方法能夠始終如一地提供高質(zhì)量的數(shù)據(jù)”����。
方法性能驗(yàn)證的目的是確認(rèn)該方法如ATP中預(yù)期的那樣運(yùn)行,在實(shí)驗(yàn)室中常規(guī)使用該程序�����,在這種情況下�,它可能取代目前的方法轉(zhuǎn)移[173]。方法驗(yàn)證通常包括專屬性�,線性(校準(zhǔn)模型)���,準(zhǔn)確度(偏差)��,精確度,檢測限(LOD)�,定量限(LLOQ和ULOQ)����,穩(wěn)定性��,重現(xiàn)性�����,耐用性�,基質(zhì)效應(yīng)等[103,174-177]���,個(gè)體的相關(guān)性很大程度上取決于ATP����。輔助方法驗(yàn)證的實(shí)驗(yàn)裝置可以從諸如用于藥物產(chǎn)品分析的ICH [103],F(xiàn)DA指南或用于生物分析方法的EU EMA指南[177-179]或國際毒理學(xué)家[175]等組織獲得����。由于根本的區(qū)別,血液學(xué)和流式細(xì)胞計(jì)數(shù)方法[180,181]在應(yīng)用特定指南的技術(shù)或共識文件可用于驗(yàn)證��。
帶有生命周期概念的QbD方法的開發(fā)也可能導(dǎo)致一個(gè)合適方法驗(yàn)證的綜合數(shù)據(jù)收集[182-186]��。
7�����、分析方法的轉(zhuǎn)移
將流程轉(zhuǎn)移到替代站點(diǎn)發(fā)生在大多數(shù)產(chǎn)品的生命周期的某個(gè)階段,從開發(fā)���,放大,制造,生產(chǎn)��、申報(bào)到批準(zhǔn)后階段[187]���。對于分析方法的轉(zhuǎn)移���,也有類似的程序[6]���。目前的方法轉(zhuǎn)移根據(jù)USP 通用章節(jié)1224的要求轉(zhuǎn)移[193]��,包括比較測試���,方法共驗(yàn)����,方法驗(yàn)證或重新確認(rèn)或作為替代策略轉(zhuǎn)讓豁免[188-192] ���。
如Nethercote和Ermer [170]在生命周期概念中所指出的���,分析方法的轉(zhuǎn)移可以被認(rèn)為是方法性能的驗(yàn)證�,參與風(fēng)險(xiǎn)評估確定����,這也被認(rèn)為是生命周期管理和連續(xù)方法驗(yàn)證的附加優(yōu)勢[170,172]。需要特別注意的是配體結(jié)合或免疫測定等方法��,結(jié)果可能會受到載體和一些關(guān)鍵試劑的影響[194]�����。
8���、連續(xù)的分析方法性能驗(yàn)證
一旦方法開發(fā)和驗(yàn)證完成�,在方法生命周期中基于風(fēng)險(xiǎn)評估和可用的數(shù)據(jù)建立方法控制策略�����,然后將該方法用于常規(guī)使用�����,持續(xù)監(jiān)測方法性能隨時(shí)間的變化(例如,通過使用控制圖表),并在需要時(shí)可以進(jìn)行改進(jìn)[63,84]�。
性能驗(yàn)證作為方法生命周期的一個(gè)重要方面�����,用于檢查該方法在常規(guī)使用中的運(yùn)行情況,結(jié)果數(shù)據(jù)是否適合其預(yù)期用途(意思是準(zhǔn)確度和精密度)����。關(guān)于“驗(yàn)證常規(guī)或連續(xù)使用的分析系統(tǒng)的可接受的性能水平”可以在USP通用章節(jié)1010“分析數(shù)據(jù) - 解釋和處理”[193]中找到����,它包括用于分析性能數(shù)據(jù)的常規(guī)監(jiān)測的連續(xù)程序��,并且可以通過跟蹤實(shí)際樣品或標(biāo)準(zhǔn)結(jié)果(趨勢分析圖)����,系統(tǒng)適用性數(shù)據(jù)的趨勢��,評估穩(wěn)定性研究和/或參考批次數(shù)據(jù)的精密度[5,193,195,196]����。驗(yàn)證實(shí)驗(yàn)還應(yīng)證明方法在參數(shù)范圍內(nèi)通過變量的目標(biāo)值從低到高的耐用性[63]��。
如果數(shù)據(jù)表明方法不能按預(yù)期運(yùn)行(例如��,實(shí)驗(yàn)室的相關(guān)信息不符合規(guī)定的結(jié)果),則應(yīng)該對變異的根本原因進(jìn)行評估。本次調(diào)查的結(jié)果可能會導(dǎo)致方法的改變從而改善(新)方法的性能[197,198]��。改變的本質(zhì)決定了所需要采取的行動:它可能是對方法設(shè)計(jì)(階段1)的改變和/或?qū)е轮匦买?yàn)證(階段2)����。
對于方法開發(fā)來說質(zhì)量設(shè)計(jì)方法的優(yōu)勢之一是方法在可操作設(shè)計(jì)區(qū)域內(nèi)的批準(zhǔn)后變更可能被視為一種調(diào)整,不需要監(jiān)管部門的批準(zhǔn)��。
9���、適用性的概念
為了確保高質(zhì)量的分析測量����,Wenclawiak等人[199]指出,“應(yīng)該使用已經(jīng)測試過的方法和設(shè)備來確保它們符合目的”����,這也包括合格的人員和工作環(huán)境���。因此,達(dá)到預(yù)定的ATP和持續(xù)評估在分析方法的整個(gè)生命周期中都是非常重要的����。根據(jù)EURACHEM [16]�����,“方法驗(yàn)證使化學(xué)家能夠證明方法的適用性”。在方法性能鑒定和驗(yàn)證過程中為了評估分析方法數(shù)據(jù)的適用性,需要根據(jù)預(yù)先設(shè)定的ATP [200-202]進(jìn)行判斷����。根據(jù)Traple 等人����、Guigues等人���,分析數(shù)據(jù)的可信度和測量的不確定性應(yīng)該被用作衡量[201-203]��,此外����,也需要考慮ATP的其他參數(shù)�����。
但是��,儀器的資質(zhì)和系統(tǒng)可以對分析生命周期產(chǎn)生積極或消極的影響,如果分析系統(tǒng)安裝不正確�,環(huán)境不適合儀器���,或儀器操作不正確�,分析數(shù)據(jù)/結(jié)果無效�。因此���,系統(tǒng)適用性試驗(yàn)應(yīng)被視為分析方法的組成部分[103]。
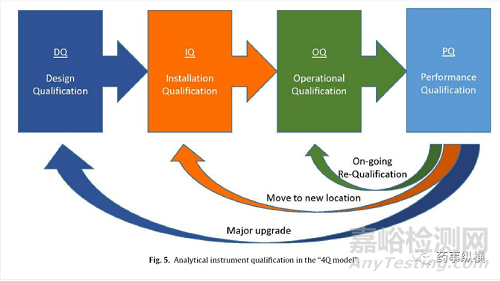
根據(jù)美國藥典通則1058 [204],分析儀器的資質(zhì)被視為數(shù)據(jù)可靠性和一致性(數(shù)據(jù)質(zhì)量)的基礎(chǔ)�����。根據(jù)QbD原則���,“4Q模型”的質(zhì)量評估過程通常用于證明分析儀器的適用性[204,205]�。4Q模型的質(zhì)量評估過程由四個(gè)部分組成。如圖5所示���,質(zhì)量驗(yàn)證過程從設(shè)計(jì)質(zhì)量(DQ)開始,其中將儀器的要求(用戶要求標(biāo)準(zhǔn)�����,URS)與儀器制造商的說明進(jìn)行比較�,訂購和交付系統(tǒng)后,開始安裝確認(rèn)(IQ)階段并交付附有部件的文件���,所有模塊的安裝以及為用戶提供的培訓(xùn)。在操作認(rèn)證(OQ)期間�,儀器在標(biāo)準(zhǔn)條件下進(jìn)行測試���,從而根據(jù)規(guī)范確認(rèn)儀器的正確操作���。之后����,質(zhì)量驗(yàn)證(PQ)通過儀器在實(shí)際條件下使用和良好的科學(xué)實(shí)踐[205]解決儀器的適用性����。
圖5:“4Q模式”中的分析儀器校驗(yàn)認(rèn)證
每次將新儀器安裝到實(shí)驗(yàn)室中時(shí)�,都會執(zhí)行完整的4Q質(zhì)量檢測程序。在儀器生命周期的特定時(shí)間段內(nèi)(通常與預(yù)防性維護(hù)程序相關(guān)聯(lián))���,必須對現(xiàn)有儀器進(jìn)行重新驗(yàn)證,以證明系統(tǒng)仍然適用。另外���,當(dāng)儀器的位置有變化時(shí),儀器經(jīng)過大的修理或修改,應(yīng)該重復(fù)IQ����、OQ和/或PQ測試[86]�。
根據(jù)USP 1058“分析儀器校驗(yàn)”[193]����,實(shí)驗(yàn)室設(shè)備風(fēng)險(xiǎn)管理分為組A至C:
A組:標(biāo)準(zhǔn)實(shí)驗(yàn)室設(shè)備(磁力攪拌器,蒸發(fā)器等)���,無需測量,無需校準(zhǔn)��,無需校驗(yàn)認(rèn)證
B組:具有測量能力的標(biāo)準(zhǔn)實(shí)驗(yàn)室設(shè)備需要校準(zhǔn)(例如天平��,pH計(jì)和溫度計(jì))�。IQ和OQ階段記錄應(yīng)符合用戶要求的情況����。
C組:復(fù)雜的儀器和計(jì)算機(jī)化的分析系統(tǒng)。所有的鑒定階段都應(yīng)符合用戶要求��。除溶出度測定儀和光譜儀外����,所有HPLC系統(tǒng)均被歸類為C類儀器。
作為風(fēng)險(xiǎn)管理的一部分���,儀器分類用來確定所需的質(zhì)量驗(yàn)證,以證明其適用性���。例如�,在HPLC分析中,在歐洲藥典(Ph.Eur.)章節(jié)2.2.46 [206]和USP藥典621章 [193] 中頻繁的系統(tǒng)適用性試驗(yàn)可以看作是對其預(yù)期用途的持續(xù)性能評估�。因此�,控制圖中系統(tǒng)適用性數(shù)據(jù)的趨勢有助于識別和理解潛在問題并采取預(yù)防措施�,防止發(fā)生重大問題[72,204,207]。
10�����、分析方法的終止
方法終止作為方法生命周期的最后階段,也應(yīng)遵循質(zhì)量管理原則��。一方面需要考慮數(shù)據(jù)存儲�����,特別是該方法用于受管制的環(huán)境下�����,然而,越來越多的研究機(jī)構(gòu)放棄原始數(shù)據(jù)存儲�。為了能夠在原始分析方法終止后的數(shù)年內(nèi)重新評估數(shù)據(jù)���,還需要考慮相關(guān)軟件的存儲[208]���。由于范圍的變化可以完全終止一種方法����,或者新的方法可能也是基于這個(gè)結(jié)論����,以滿足新的ATP要求[209]。如果新的方法是基于被終止的分析方法���,早期的一些研究可能會用到����。
11、展望
制藥行業(yè)內(nèi)實(shí)施的ICH準(zhǔn)則Q8~Q11�����,以更科學(xué)和風(fēng)險(xiǎn)管理為基礎(chǔ)的方法���,將目前的藥物開發(fā)和制造方法現(xiàn)代化����。雖然ICH準(zhǔn)則Q8沒有明確提及分析方法開發(fā),但是在藥物開發(fā)中要求使用QbD方法[14]���,因此,QbD的概念可以擴(kuò)展到分析方法��,USP的代表性文章也遵循了這個(gè)趨勢��。
盡管ICH準(zhǔn)則 Q8�、Q9�����、Q10�����、Q11中提供了更科學(xué)和基于風(fēng)險(xiǎn)的方法來評估整個(gè)生命周期中的變化,但仍存在一些限制完全實(shí)現(xiàn)預(yù)期效益的缺陷����,預(yù)期的批準(zhǔn)后靈活性沒有實(shí)現(xiàn)。因此,新提出的ICH準(zhǔn)則Q12將提供批準(zhǔn)后變更指導(dǎo),以便在整個(gè)產(chǎn)品生命周期中以可預(yù)測和有效的方式管理����。采用這一新的ICH指導(dǎo)方針將促進(jìn)創(chuàng)新和持續(xù)改進(jìn)���,并加強(qiáng)產(chǎn)品的質(zhì)量保證和可靠供應(yīng)[Q12]�。關(guān)于分析方法的生命周期的ICH指導(dǎo)原則和USP新通則還在繼續(xù)討論中�。